突破性药物的海外时速与中国路径
发布时间:2022-03-14 14:06:43作者:秦卫华(中山大学药学院新药研究与开发中心常务副主任)来源:医药经济报
《药审中心加快创新药上市申请审评工作程序(试行)(征求意见稿)》将适用品种范围定为纳入突破性治疗药物程序的创新药,旨在优先考虑最重要、有望提供优于现有疗法的药物,以便患者更快地获得急需的药物,满足未满足的临床需求。
海外实践
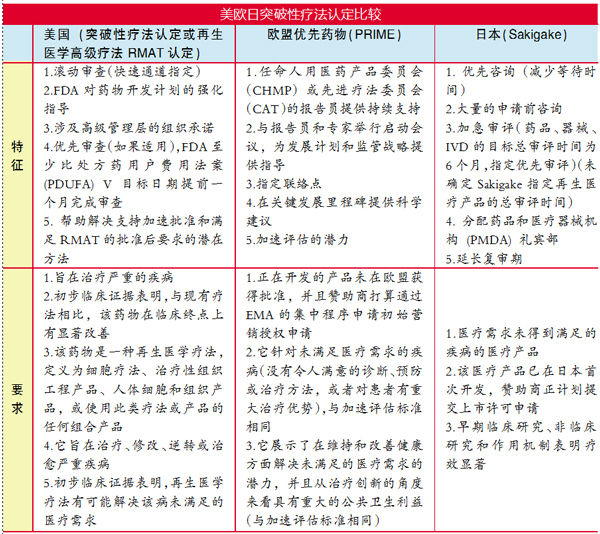
美国、欧盟和日本等国家或地区已经制定相关法规并实施,尽管这些加快审批计划是独立并且建立在不同的法律基础上,但它们具有相似的目标,包括使患者能够及时获得创新药物、加强申请人与监管机构之间的对话,以及对通用技术文件(CTD)进行滚动审查(见附表)。
以美国为例,FDA实施了四项计划,以促进和加快开发或审查用于治疗严重或威胁生命的疾病的创新药物,包括快速通道、优先审查、加速批准和突破性疗法认定。
突破性疗法认定于2012年设立,要求如下:1.产品用于严重疾病;2.初步临床证据显示与现有疗法相比有显著改善。该认定的特点是FDA早期介入、对药物开发计划的密集指导、涉及高级管理人员的组织承诺和滚动审查系统。鉴于此,突破性疗法认定的优势包括快速通道指定的所有好处。
值得注意的是,一项对从2012年到2017年授予突破性疗法认定的所有FDA批准的研究表明,这些批准的关键试验通常缺乏随机双盲对照组、使用替代标志物作为主要终点,并且仅招募了少量患者。因此,如果在进入市场之前无法避免使用非随机和非对照研究,应在上市后阶段强制进行随机试验。除非有充分的理由不进行此类研究,并在上市前,更严格地评估其与患者临床结果的相关性,以提高替代标志物的有效性。
中国启示
抗疫经验和成果证明,创新性药物不仅来自现代技术,传统药物治疗与现代治疗组合亦可能带来比现有治疗手段更好的疗效或更小的副作用。而传统药物进入国际市场,需要与各国、各地区对传统药物的法规要求接轨,如在临床前和临床研究方面能与目标地区法规接轨、互为认可,将更有利于进入国际市场。
此外,《意见稿》提到,“现有治疗手段是指在境内已批准用于治疗相同疾病的药品,或者标准治疗方法(药械组合治疗等)。通常,这些治疗手段应为当前标准治疗。”因此,在本土是否可获得突破性疗法认定与该类已经批准的药品的疗效和副作用有关,在拟进入申请突破性疗法认定前,需要对所申请新药的功效和副作用进行对比,具有自己的优势。进入其他国家或地区要获得该地区的突破性疗法认定,则需要与当地的已有药品进行比较,并深入研究其有关规定。例如,日本认定时有在其本土率先开发的要求,相关企业应给予足够的关注。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






