上市申请过审提速靠什么?
发布时间:2022-03-07 13:53:58作者:赵书敏来源:医药经济报
21个纳入优先审评审批程序的1类新药实施情况分析:速度快慢取决于哪些因素?
近日,国家药品监督管理局药品审评中心公开征求《药审中心加快创新药上市申请审评工作程序(试行)》(以下简称《工作程序》)意见。此《工作程序》主要适用于纳入突破性治疗药物程序的创新药,对适用范围内的创新药审评时限、工作程序、工作要求做出相关要求。
根据《药品注册管理办法》,突破性治疗药物程序是药品加快上市注册的程序之一,但其中并未有明确的审评时限要求。此次《工作程序》的征求意见稿提出,审评时限参考优先审评品种的时限,设定为130个工作日。
加快创新药上市申请审评工作,对鼓励研究和创制新药、满足临床需求作用关键。
目前,在CDE官网上,共有93个品种纳入突破性治疗品种名单,都还处于临床阶段。因此,突破性治疗药物程序的创新药尚未有“上市申请审评”的实践数据。此次《工作程序》亦是吸取抗疫应急审评过程中“早期介入、研审联动、滚动提交”等宝贵经验,希望尽量加快审评速度。
那么,《工作程序》征求意见稿设置的130个工作日时限,相当于怎样的速度呢?我们不妨看看此次参考的另一个药品加快上市注册程序——优先审评审批程序的实施情况。
最快不到200天完成制证,“快”在哪里?
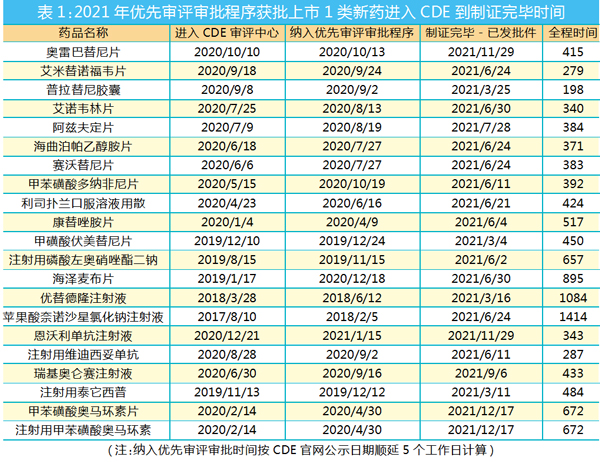
2021年,共有21个1类新药纳入了优先审评审批程序,不妨一起来看看这些药品的上市申请审评审批过程都花了多少时间。
整体来看,从上市申请“进入CDE审评中心”开始到“制证完毕-已发批件”,审评审批全程时间最短的是基石药业的普拉替尼胶囊,只花了198天。
普拉替尼胶囊快在哪里?虽然并不清楚基石药业与CDE的沟通情况,仅从其审评审批过程关键时间点的记录来看,它的“快”至少体现在以下几个方面:
①纳入优先审评审批程序的申请快速通过
首先,普拉替尼纳入优先审评审批程序的申请很快就通过了,而且早于上市申请进入CDE审评中心。普拉替尼胶囊的优先审评审批程序的申请之日是2020年8月21日,5天后,即2020年8月26日就进行了公示。由此看来,CDE对普拉替尼胶囊符合优先审评审批程序基本是没有异议的,这恐怕离不开基石药业充分的资料准备及事前沟通。根据《药品上市许可优先审评审批工作程序(试行)》,公示5日内无异议的即纳入优先审评审批程序。这样算来,普拉替尼胶囊纳入优先审评审批程序时,上市申请还没进入CDE审评中心。
当然,在这一关走得又早又快的也不少,例如顺健生物的奥雷巴替尼片。
②没有进入补充资料任务序列
其次,在这21个药品中,只有2个药品没有进入补充资料任务序列,普拉替尼胶囊便是其中之一。普拉替尼胶囊在新报任务的药理毒理、临床、药学三大专业审评完成后,很快就进入了NMPA审批环节。而这个环节一般都不长。于是,普拉替尼胶囊不到一年时间就完成了上市申请的审评审批。
“慢”的理由?补充资料是重要的“槛”
纵观21个纳入优先审评审批程序的1类新药,没有比普拉替尼胶囊走得更顺的。那么,其他新药“慢”在哪里?
补充资料绝对算得上其中一个很重要的“槛”。
前面提到,21个药品中只有2个没有进入补充资料任务序列,除了普拉替尼胶囊,就是第二个国产CAR-T产品瑞基奥仑赛注射液。不过,由于药监部门对细胞免疫疗法类产品的态度还是非常谨慎,瑞基奥仑赛注射液和第一个国产CAR-T产品阿基仑赛注射液一样,在完成药理毒理、临床、药学三大专业审评后,又讨论了几个月才进入NMPA审批环节。
其他19个药品均经历了补充资料后再次审评的过程。
一旦需要补充资料,就很难快起来了。
当然,由于需要补充的资料难易不同,每个药品完成这些资料的补充、重新进入审评需要的时间不同。这19个药品中,以首轮完成三大专业审评到进入补充资料任务序列的时间间隔来看,最短的是注射用维迪西妥单抗,耗时约一个月,最长的差不多17个月,大多数药品这个过程需要2~3个月。
进入补充资料任务序列后的审评时长差异比首轮审评更大。时间短的1~2个月就能完成审评,慢的则需要一年左右(从状态变化时间来看,可能经历了不止一次补充资料)。
纳入优先审评审批,真的快了吗?
对于这个问题,笔者没有做太大范围的数据统计。但从2021年获批上市的1类新药来看,纳入优先审评审批程序的药品,最终上市申请完成的时间并不一定比没有进入此程序的药品快。
2021年获批上市的33个1类新药中,从上市申请“进入CDE审评中心”开始到最后“制证完毕-已发批件”,纳入优先审评审批程序的21个药品平均经历了528天,而其他12个药品则平均经历了459天。
如果只算首轮审评,从“进入新报任务序列”开始到三大专业审评完成时间,纳入优先审评审批程序的21个药品平均经历了149个工作日,而其他12个药品则平均经历了146个工作日。
值得注意的是,21个药品也不全是一进入CDE就纳入了优先审评审批程序。有些药品在上市申请还没进入CDE之前就开始申请纳入优先审评审批程序,有些则是上市申请进入CDE审评中心许久后才申请的。而从申请到纳入的时间间隔亦有长短。因此,如果从这些药品纳入优先审评审批程序开始算,到三大专业审评最晚完成时间,首轮审评平均经历了101个工作日。
但即便如此,纳入优先审评审批程序真的不一定就会比没纳入的快。虽然有像198天完成全过程的普拉替尼胶囊,但也有不少需要反复与CDE沟通、补充资料甚至二度补充资料的药品。
没纳入优先审评审批程序的也有很快过审者。2021年获批的1类新药中,没纳入优先审评审批程序的12个药品中,有一半是在一年左右完成整个审评审批过程,仅2个药品耗时超过了2年。
上市申请过审,如何才能快起来?
那么,究竟上市申请过审如何能快起来?这个问题的答案也许就在此次《工作程序》征求意见稿的起草说明里——“早期介入、研审联动、滚动提交、检查检验靠前”!
这不仅是对审评团队而言,亦是对申请人而言。把研究和临床做扎实了,早期沟通透彻了,资料准备完善了,“返工”的可能性就少了。
如此才能真正地提速!
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






