重磅晚期项目六大焦点 2022谁能通关?
发布时间:2022-01-26 16:54:49作者:本报特约撰稿 李勇来源:医药经济报
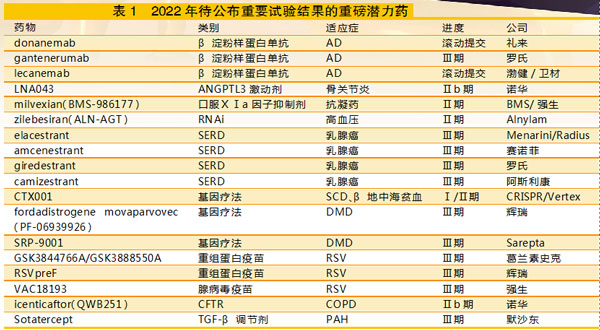
在癌症、中枢神经系统疾病、心血管疾病、关节炎以及罕见病等领域,有多款具有重磅潜力疗法的药物进入临床试验晚期阶段,将在2022年公布研究数据。
这些重要的试验结果将决定这些药物的下一步开发计划、监管批准甚至未来的市场命运,备受业界关注。
焦点1
AD重焕激情
渤健/卫材的靶向β淀粉样蛋白阿尔茨海默病(AD)药物Aduhelm(aducanumab)获批,成为2021年最大的监管里程碑和争议事件之一。尽管如此,Aduhelm的批准增强了同类药物其他开发者的决心,纷纷推进各自药物的申请批准计划,对这些项目至关重要的数据也将于2022年公布。
礼来donanemab
礼来2021年10月开始向FDA滚动提交donanemab生物制品许可申请(BLA),计划在2022年第一季度完成。该申请基于Ⅱ期数据,使用淀粉样蛋白斑块的清除作为临床疗效的替代标志物。礼来希望donanemab在2022年末获得该药物的批准,同时还在进行一项验证性的Ⅲ期试验和一项预防性研究。donanemab与Aduhelm头对头试验的初步数据也将在2022年公布。
罗氏gantenerumab
罗氏的gantenerumab正在进行Ⅲ期试验,将于2022年下半年公布结果。几年前gantenerumab未能通过Ⅲ期试验,但罗氏认为以更高剂量可以提高其清除淀粉样蛋白疗效,从而使该项目复活。罗氏还将尝试开发gantenerumab的皮下给药途径。
渤健/卫材的lecanemab
渤健/卫材开发的lecanemab已于2021年9月向FDA滚动提交。正在进行一项Ⅲ期试验,结果将于2022年9月公布。
焦点2
传统领域求新
骨关节炎:诺华LNA043(ANGPTL3激动剂)
骨关节炎通常易被制药行业忽视。然而,诺华逆势而上,目前正在进行一种新药血管生成素样蛋白3(ANGPTL3)激动剂LNA043的Ⅱb期试验。LNA043于2021年9月获得FDA的快速通道指定。
LNA043由诺华生物医学研究所(NIBR)开发,是人类ANGPTL3的改良重组版本,可促使关节中的细胞再生软骨,通过直接注射到病变关节给药。如果成功,该药可能成为解决骨关节炎疾病发生潜在软骨损伤的新型疗法。
Ⅱb期试验预计将在2022年底之前公布首批结果,但后续研究要到2024年才能完成。
抗凝药:BMS/强生milvexian(Ⅺa因子抑制剂)
2021年11月,百时美施贵宝(BMS)和合作伙伴强生报告了milvexian(BMS-986177)的第一个概念验证数据。milvexian是BMS重磅抗凝药Eliquis(阿哌沙班)的后续产品,有望成为市场上第一个口服Ⅺa因子抑制剂。
milvexian可与Eliquis和强生/拜耳的Xarelto(利伐沙班)等靶向Ⅹa因子类药物的疗效相媲美,又能避免出血副作用的风险升高。
AXIOMATIC-TKR试验的结果表明,milvexian可预防接受全膝关节置换手术的静脉血栓栓塞(VTE),而不会增加出血风险。这些数据已在2021年美国心脏协会(AHA)大会上公布,并发表在《新英格兰医学杂志》上。
现在,所有人的目光都集中在第二个中期试验AXIOMATIC-SSP上,旨在研究milvexian在预防中风或短暂性脑缺血发作患者继发性中风方面的潜力。AXIOMATIC-SSP将于2022年上半年公布结果。
高血压:Alnylam的zilebesiran(RNAi药物)
由于可降低某些慢性疾病患者给药频率,RNA干扰(RNAi)或基因沉默药物仍是极具诱惑的技术领域之一。
Alnylam的RNAi药物zilebesiran(ALN-AGT)靶向血管紧张素原(AGT),进而调节体内血压,且每年仅需给药2次或4次。在Ⅰ期试验中,zilebesiran在12周内具有良好的耐受性,单次注射即可持久,剂量依赖性地降低血液中的AGT水平并改善收缩压。
Alnylam已开始一项针对轻度至中度高血压(KARDIA-1)的Ⅱ期试验,该试验正在对约375名患者进行单一疗法的测试,以观察其是否能安全地控制血压,结果将于2022年底公布。
Alnylam还计划启动第二项规模稍大的Ⅱ期试验(KARDIA-2),该试验将在大约800名未控制的高血压患者中检查该药作为传统降压药附加疗法的潜力。
焦点3
SERD迎突破
四家角逐,或将后来者居上
2022年,口服选择性雌激素受体降解剂(SERD)将成为乳腺癌领域广泛使用的注射药物替代品。
SERD的开发一直是在阿斯利康、罗氏和赛诺菲之间的角逐,Menarini/Radius加入后,迅速处于领先地位。
Menarini和Radius于2021年10月报告了合作开发elacestrant的Ⅲ期试验的顶线数据,2022年将在美国和欧洲提交上市申请。两家公司计划在近期发布完整的数据,有望超越罗氏giredestrant、赛诺菲amcenestrant和阿斯利康camizestrant,首先获得批准上市。
与此同时,赛诺菲在其AMEERA-3研究延迟之前一直处于领先地位,amcenestrant作为二线疗法,可能在2022年初公布结果。在SERENA-2试验中,阿斯利康的camizestrant有类似的试验设计和研究时间表。而罗氏giredestrant的acelERA研究属于二线和三线疗法,预计在2022年上半年公布结果。
焦点4
基因疗法热度不减
SCD/β地中海贫血:两家竞争
CRISPR/Vertex正在与Bluebird展开竞争,将针对罕见血液疾病镰状细胞病(SCD)和β地中海贫血的一次性基因疗法引入美国市场。
CRISR/Vertex一直在稳步更新其基因编辑疗法CTX001的Ⅰ/Ⅱ期试验数据。研究患者现已全部入组,正在等待随访期结束,然后才能最终确定结果。如果一切顺利,CRISR/Vertex计划在2022年底之前向FDA提交上市申请。
CTX001是一种离体基因疗法,使用CRISPR/Cas9基因编辑来修改患者的造血干细胞,使其产生具有高水平胎儿血红蛋白的红细胞,以取代在地中海贫血和SCD中看到的有缺陷的版本。
地中海贫血试验CLIMB-111和SCD试验CLIMB-211此前数据显示胎儿血红蛋白水平增加,SCD疼痛发作减少,并可减少地中海贫血对输血的依赖。
然而,这些试验也面临一些疑问,包括其效果是否足够持久?是否足以让CTX001被视为对这些疾病的功能性治愈?有迹象表明,胎儿血红蛋白水平会随着时间的推移而下降。安全是另一个考虑因素,CTX001治疗中出现了一些不良事件。
Bluebird的地中海贫血症疗法Zynteglo(betibeglogene autotemcel或beti-cel)2019年在欧洲获得批准,但2021年夏未在德国达成定价协议后完全退出欧洲。2021年9月,Bluebird向FDA提交beti-cel用于地中海贫血的上市申请。
Bluebird在欧洲遭遇的困境也许为Vertex/CRISPR提供了一个机会。
DMD:三强格局
杜氏肌营养不良症(DMD)基因疗法的开发正在形成一场三强竞争的格局:辉瑞、Sarepta和Solid Bio都在致力于开发以促进肌营养不良蛋白产生的基因疗法,可能会在2022年进入最后冲刺阶段。
辉瑞是第一个将其fordadistrogene movaparvovec(PF-06939926)候选药物推进Ⅲ期临床试验阶段的公司,但在报告了三例肌肉无力(包括心脏组织炎症或心肌炎)病例后,该公司被迫收紧了其入组标准。目前,所有登记的患者都在欧洲和亚洲,因为FDA尚未批准辉瑞开始在美国用于治疗患者。尽管辉瑞仍预计该试验将在2022年底之前公布结果,但实际上将不得不推迟时间表。
与此同时,Sarepta正在对其候选药物SRP-9001进行Ⅲ期EMBARK试验,该试验于2021年10月开始。不过,这并不是Sarepta在2022年的关键数据。该公司正在等待其中期研究的第二个数据集,在2021年初报告第一阶段数据时未达到主要终点。SRP-9001确实显示出改善DMD患者步行能力的趋势,但没有统计学意义,因此2022年的数据将是SRP-9001潜力的关键指标。如果是积极的,Sarepta可能会提前向FDA提交上市申请。
另一个基因治疗竞争者是Solid Bio的SGT-001,开发速度略落后于两个竞争对手。Solid在2021年的Ⅰ/Ⅱ期研究中期结果令人失望。该研究于2019年因肝脏和血小板副作用被FDA推迟。不过,Solid将对更多患者进行试验。到2022年底,三种基因疗法的潜力将会更加清晰。
焦点5
RSV,疫苗新战场
三强进入决赛
葛兰素史克(GSK)、辉瑞和强生,谁将是第一个将呼吸道合胞病毒(RSV)疫苗推向市场的企业?2022年应该是衡量结果的重要一年。
GSK的GSK3844766A/GSK3888550A和辉瑞的RSVpreF是重组蛋白亚单位疫苗,而强生的腺病毒疫苗VAC18193使用与其COVID-19疫苗相同的技术平台。GSK和辉瑞的疫苗正在开发用于两种应用:作为一种旨在保护婴儿在生命最初几个月免受RSV感染的母体疫苗,以及作为老年人的注射剂。而强生目前主要专注于成人市场。
2021年,三种疫苗都在主要着眼于刺激RSV中和抗体的中期试验中取得了积极成果,并且都进入了Ⅲ期研究中,预计2022年数据将会公布。
辉瑞遥遥领先,预计将在2022年上半年报告RSVpreF在成人(RENOIR研究)和孕产妇患者(MATISSE研究)中的Ⅲ期试验结果。
与此同时,GSK预计其GSK3844766A的AReSVi004研究的中期结果将于2022年在成人中提供其专有的AS01佐剂公布,并于2024年进行最终读数;来自其无佐剂母体注射GSK3888550A的Ⅲ期试验的第一批数据也将公布。对于强生,关键数据将来自2022年下半年对VAC18193的EVERGREEN研究。
mRNA疫苗处于更早期阶段
其他制药商拥有更早开发阶段的RSV候选疫苗,包括来自Moderna的基于mRNA的疫苗,该疫苗于2021年11月在成人中开始了Ⅱ/Ⅲ期试验。赛诺菲曾表示,预计2022年将为幼儿提供减毒活RSV疫苗的Ⅰ/Ⅱ期结果。该公司还有针对成人市场的mRNA疫苗,计划于2023年开始临床测试。
焦点6
罕见病药追逐更高目标
囊性纤维化药物转治COPD能否成功?
诺华的icenticaftor(QWB251)是一种囊性纤维化跨膜电导调节剂(CFTR)的口服活性增效剂或开启剂,最初被用于治疗囊性纤维化受挫后,诺华正在将icenticaftor用作慢性阻塞性肺疾病(COPD)药物进行开发。目前为止,研究结果喜忧参半。
在一项概念验证研究中,与安慰剂相比,在患者使用支气管扩张剂前后测量的基线肺功能变化方面,icenticaftor取得了适度的改善。该药还改善了炎症的生物标志物并减少了痰细菌定植。
但该药物未能实现该研究的主要目标,即减少肺部感染,这是COPD的常见并发症。然而,诺华有足够的信心开始一项Ⅱb期剂量范围研究。现在已经完成招募,结果将于2022年上半年公布,Ⅲ期研究计划将于2023年进行。
icenticaftor还在进行另一项用于支气管扩张症的平行概念验证研究。
Sotatercept有望成为PAH治疗新标准?
默沙东以115亿美元收购Acceleron是2021年最大的生物技术并购交易之一,该交易的焦点是肺动脉高压(PAH)候选药物Sotatercept。
Sotatercept对交易至关重要,Acceleron的激进投资者试图推迟收购,以等待正在进行的Ⅲ期试验结果,希望能提高报价。
该交易的重大转折点将在2022年出现,届时Sotatercept的STELLAR试验将会公布,该药在拥挤的PAH市场中的前景会变得更加清晰。
目前上市的PAH药物主要是通过松弛血管发挥治疗PAH的症状,包括内皮素受体拮抗剂(Actelion的Tracleer和Opsumit/吉利德的Letairis)、重新利用的PDE5抑制剂(Viatris的Revatio和United的Adcirca)和前列环素(United的Remodulin和Janssen的Uptravi)。
Sotatercept是一种TGF-β调节剂,旨在重新平衡BMP和激活素信号通路,这些通路被认为会导致PAH中的血管重塑。相比之下,sotatercept旨在成为解决该疾病潜在病理的第一种疗法。如果sotatercept在STELLAR中达到终点,有望成为PAH治疗的新标准。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






