聚焦2021年上市1类新药 它们凭什么熠熠生辉?
发布时间:2021-12-22 14:06:09作者:赵书敏来源:医药经济报
2021年已经接近尾声,又到了年终盘点的时候。让我们一起来盘点今年获批上市的1类新药。
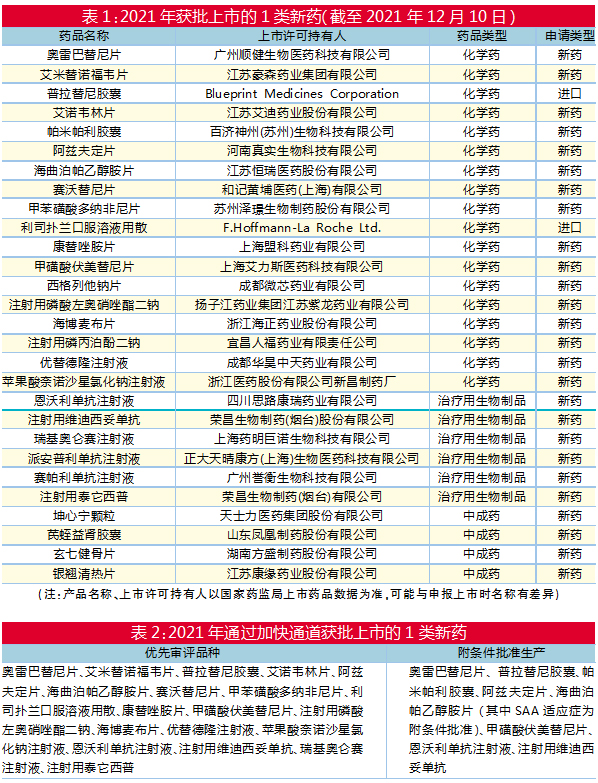
截至2021年12月10日,2021年已有28个1类新药获批上市(按药品名称计算,新增规格、新增适应症不计算入内),其中化学药最多(有18个),治疗性生物制品有6个,中成药有4个。
没有无缘无故的收获。笔者认为,小分子药、快速通道和中药新药是值得总结的3个亮点。
亮点1 小分子药
与大分子药相比:小分子药拥有四大优势
2021年获批上市的1类新药中,数量最多的依然是小分子化学药,约占三分之二。虽然近年来大分子药物大热,但小分子药依然是创新药品中的主流。
小分子药具有其独特的优势。与大分子药物相比,笔者总结小分子药至少有以下4个方面的优势:
①小分子药物给药途径较多,可口服、注射、表层抹涂。而大分子药物通常需要采用注射的方式。
②小分子药物大多可以细胞跨膜,通过合理设计可跨越血脑屏障。而这两点,大分子药物中的抗体类几乎做不到;siRNA和基因编辑(体内)虽然可以依靠载体进行细胞跨膜,但血脑屏障较难跨越。
③小分子药物潜在可作用靶点较多,机制灵活多样,可通过分子层面靶向结合实现靶向性,适应症广泛。而大分子药物的适应症主要集中在抗肿瘤和免疫调节领域。
④小分子药物还具有生产成本相对较低、质量控制相对较好的特点。
以2021年获批上市的1类化学药为例,18个品种既有口服制剂,又有注射制剂,分布在7大产品类别中。其中,以抗肿瘤和免疫调节剂最多(有7个),全身用抗感染药物亦有6个,另外还有神经系统药物、肌肉骨骼系统药物、消化系统及代谢药物、心血管系统药物、血液和造血系统药物各1个。
与之相对的是,6个获批的1类治疗性生物制品、大分子药物均是注射制剂,均为抗肿瘤或免疫调节剂。
亮点2 快速通道
28个1类新药中,有19个优先审评品种
新《药品注册管理办法》增加了4个药品注册快速通道,分别为突破性治疗药物、附条件批准、优先审评审批、特别审批。2021年获批上市的1类新药中,大部分是通过快速通道获批的。
根据《药品注册管理办法》,临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药、符合儿童生理特征的儿童用药品新品种/剂型/规格、疾病预防或控制急需的疫苗和创新疫苗、纳入突破性治疗药物程序的药品、符合附条件批准的药品等,可以申请优先审评审批程序。纳入优先审评审批程序后,药品上市许可申请的审评时限为130日;临床急需的境外已上市境内未上市的罕见病药品,审评时限为70日;需要核查、检验和核准药品通用名称的,予以优先安排等。
2021年获批上市的28个1类新药中,有19个优先审评品种,包括中国首个第三代BCR-ABL靶向耐药CML治疗药物奥雷巴替尼片(曾用名“奥瑞巴替尼片”)、首个抗HIV双靶点创新药阿兹夫定片、中国首款MET靶向药赛沃替尼片(曾用名“沃利替尼片”)、新一代噁唑烷酮类抗菌药康替唑胺片、首个在中国获批治疗罕见神经疾病脊髓性肌萎缩症(SMA)的利司扑兰口服溶液用散、全球首款兼同类首创的双靶点抗体融合蛋白药物注射用泰它西普等。
附条件批准药品是适用优先审评审批程序的其中一种情况。根据《药品注册管理办法》,治疗严重危及生命且尚无有效治疗手段的疾病的药品,药物临床试验已有数据证实疗效并能预测其临床价值的,公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的,应对重大突发公共卫生事件急需的疫苗或者国家卫生健康委员会认定急需的其他疫苗,经评估获益大于风险的可以申请附条件批准。
与正常批准药品相比,《药品注册管理办法》要求附条件批准的药品上市后需要继续完成的研究工作,但对于完成时限并没有统一规定。
2021年获批上市的28个1类新药中,有8个附条件批准生产,包括奥雷巴替尼片、普拉替尼胶囊、帕米帕利胶囊、阿兹夫定片、甲磺酸伏美替尼片、恩沃利单抗注射液、注射用维迪西妥单抗,而海曲泊帕乙醇胺片仅其中一个适应症(SAA)为附条件批准。
亮点3 中药创新药
2021年获批4个,为近5年最多的一年
根据新修订的《药品注册管理办法》,为突出中药优势,充分考虑中药特点,明确国家鼓励运用现代科学技术和传统研究方法研制中药,建立和完善中药特点的注册分类和技术评价体系,促进中药传承创新。
2021年11月,中药创新药获批消息接二连三传来。
2021年11月9日,1类中药新药银翘清热片获批上市,这是自2020年7月1日新的中药注册分类实施以来首个获批上市的中药创新药。该药上市许可持有人为康缘药业,用于外感风热型普通感冒的治疗。
随后又陆续传来几个中药创新药获批好消息:国家药品监督管理局批准了玄七健骨片、芪蛭益肾胶囊和坤心宁颗粒3个1类中药创新药的上市注册申请。玄七健骨片的上市许可持有人为方盛制药,用于轻中度膝骨关节炎中医辨证属筋脉瘀滞证的治疗;芪蛭益肾胶囊的上市许可持有人为凤凰制药,用于早期糖尿病肾病气阴两虚证的治疗;坤心宁颗粒的上市许可持有人为天士力,用于女性更年期综合征中医辨证属肾阴阳两虚证的治疗。
此外,2021年国家药监局还紧急批准了在新冠疫情中立下“战功”的“三药三方”中的“三方”——清肺排毒颗粒、化湿败毒颗粒、宣肺败毒颗粒上市,“三方”均按3.1类注册上市。
2021年已经成为近5年来获批中药新药最多的一年,中药审评审批制度改革已初显成效,中药创新药迎来了新的发展机遇。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






