赋码产品超60万 UDI助推械企国际化
发布时间:2021-11-22 15:27:16作者:余耿楠 杨雳 许佳锐来源:医药经济报
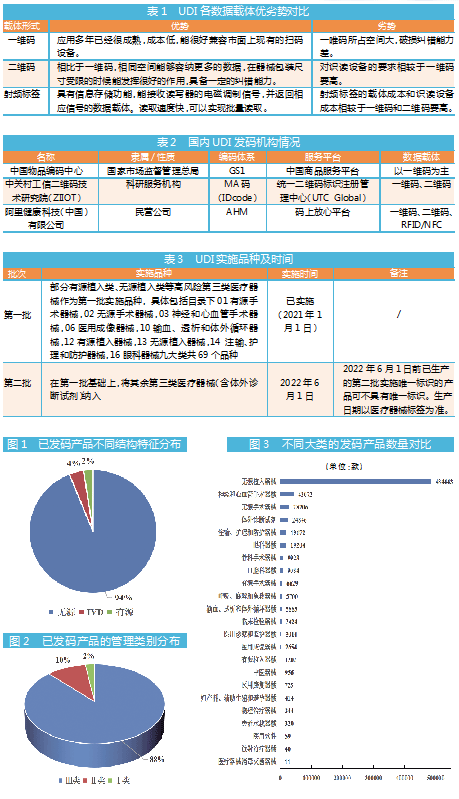
医疗器械唯一标识制度是落实国务院治理高值医用耗材改革和深化医药卫生体制改革的重点工作,也是提升医疗器械监管效能、强化全生命周期精细化管理、促进产业高质量发展的重要举措。
经过唯一标识试点,今年1月1日起,首批9大类69个医疗器械品种正式实施唯一标识。《国家药监局 国家卫生健康委 国家医保局关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告》(2020年第106号)规定,在9大类69个品种的基础上,将其余第三类医疗器械(含体外诊断试剂)纳入第二批实施唯一标识范围,并于2022年6月1日起实施。
从政府管理角度看,利用唯一标识,可实现对医疗器械的来源可查、去向可追、责任可究,从而实现智慧监管。
两大落地时间点
医疗器械唯一标识(Unique Device Identification,简称UDI)是呈现在医疗器械产品或者包装上的由数字、字母或者符号组成的代码,由产品标识(DI)和生产标识(PI)组成,被视为医疗器械的“电子身份证”。产品标识是识别注册人/备案人、医疗器械型号规格和包装的唯一代码,是从数据库获取医疗器械相关信息的“关键字”,是唯一标识的必须部分;生产标识包括与生产过程相关的信息,包括产品批号、序列号、生产日期和失效日期等,可与产品标识联合使用,满足医疗器械流通和使用环节精细化识别和记录的需求。
当前,市面上常用的数据载体包括一维码、二维码和射频标签(RFID),注册人/备案人可根据产品的特征、价值、主要应用场景等因素选择适当的医疗器械唯一标识数据载体。
实施UDI重要的一步,是选择正确的发码机构。目前,国家药监局认可的UDI发码机构有3家,分别是中国物品编码中心(GS1)、中关村工信二维码技术研究院(MA码)和阿里健康科技(中国)有限公司(AHM)。
第一批实施医疗器械唯一标识的9大类69个品种自2021年1月1日起,涉及该类品种企业必须全部赋码上市。在第一批基础上,其余第三类医疗器械(含体外诊断试剂)纳入第二批实施品种,自2022年6月1日起实施。
已赋码产品五大特点
1.GS1为当前UDI主流编码体系
据众成大数据平台统计,截至2021年9月底,共有667825款产品具有UDI码。其中,GS1编码产品数量最多,占据95.8%,其次是MA码,产品数量占比4.2%,而AHM编码产品数量极少,仅26款。可以看出,目前医疗器械产品的编码体系主要为GS1和MA码。
2.已发码产品耗材类为绝对主力
在已发码的667825款产品中,共有657477款耗材产品,10348款设备产品,耗材类产品数量占据98%。从不同结构特征的产品数量来看,无源类产品为627396款,占比94%;IVD类产品为24765款,占比4%;有源类产品15664款,占比2%。从管理类别来看,Ⅲ类产品共有588521款,占比88%;Ⅱ类产品共有64401款,占比10%;Ⅰ类产共有14903款,占比2%。
3.无源植入器械占比超七成
从产品分类分布来看,已发码的医疗器械产品覆盖了《国家医疗器械分类目录》内的22个大类,外加体外诊断试剂共23大类。其中,无源植入器械有484443款,占比73%,总数排名第一;神经和心血管手术器械、无源手术器械分别以43072款和28206款位列第二、三名;体外诊断试剂,注输、护理和防护器械分别以24846款和19672款处在第四、五位。此外,医用软件、放射治疗器械和医疗器械消毒灭菌器械现有发码产品均未超过百件。
4.已发码产品近八成为国产
目前已发码产品79%为国产产品,21%为进口产品。从进口产品注册地来看,以北美、欧洲、东南亚地区为主。其中,美国、瑞士、德国、西班牙、荷兰、日本、爱尔兰、法国、英国和比利时为排名前十的注册地。
5.江苏发码产品数领跑全国
从国产产品注册地来看,UDI推进工作已覆盖全国28个省(市、自治区),西藏、青海、内蒙古和宁夏暂无相关产品发码,江苏、山东、北京、天津、广东、浙江、福建、上海、四川、湖南是目前发码产品最多的十个地区。
结语<<<
自2021年1月1日实施第一批医疗器械产品唯一标识工作以来,已有超过60万医疗器械产品赋码,拥有了唯一标识。其中绝大部分产品为耗材产品,尤其是无源植入器械、神经和心血管手术器械以及无源手术器械,且多为Ⅲ类产品,与政策要求的实施品种基本一致。
除政策要求实施的九大类产品外,体外诊断试剂及其他13大类产品均有不同数量的产品实施了唯一标识,尤以体外诊断试剂产品实施数量最多。未来随着UDI政策的深入推广,UDI推向医疗器械全品种产品只是时间问题。
UDI的推行有利于实现透明化、可视化、智能化的医疗器械全流程监管,从推广范围来看,目前全球发达国家实施医疗器械全生命流程监管已是大势所趋。随着国内UDI实施标准和政策要求逐步与国际接轨,国内医疗器械企业的国际化发展有望步入“快车道”。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






