赛道挤?同质化? 合力突围另辟蹊径
发布时间:2021-11-17 15:14:30作者:本报特约撰稿 李勇来源:医药经济报
赛道挤?同质化?
合力突围另辟蹊径
近年来,国内新药开发达到了前所未有的高度。在新药批准数量屡创新高、给临床用药带来更多选择的同时,生物制药行业却面临着巨大发展压力。如何促进行业健康发展成为业界关注的焦点之一。而PD-1/L1、CAR-T等热门领域的发展现状成为前车之鉴。
PD-1/L1:热度减退,避之不及?
降价,市场规模收缩
2018年6月起,百时美施贵宝的纳武利尤单抗、默沙东的帕博利珠单抗在国内获批上市后,国产PD-1/L1便如雨后春笋般发展起来。
目前国内已上市6款国产PD-1单抗,分别是:君实生物的特瑞普利单抗、信达生物的信迪利单抗、恒瑞医药的卡瑞利珠单抗、百济神州的替雷利珠单抗、康方生物的派安普利单抗以及誉衡生物的赛帕利单抗。与此同时,还有多款PD-1/L1产品正在上市申请中或进入临床试验阶段。
国产PD-1单抗陆续获批上市,加剧了市场竞争并降低了企业预期利润。2019年,信达生物信迪利单抗降价63.73%率先进入医保目录;在去年底进行的医保谈判中,恒瑞医药、百济神州、君实生物三家的PD-1单抗也成功进入医保目录,价格平均降幅为78%。
根据君实生物2018年底赴港上市时披露的文件,中国PD-1/L1市场仍处于发展初期,具有强劲的增长潜力,该领域的市场规模预期将增长至2030年的984亿元。
PD-1单抗的大幅降价让曾经被认为的“千亿市场”大规模缩水。西南证券近期发布的研报预计,如果PD-1单抗的完整年度年用药金额假设为医保谈判后的6万元,则我国PD-1单抗总市场空间为305亿元;如果PD-1单抗的价格下降到完整年度3万元,预计市场规模可能收缩到236亿元。
开发成本加大,战略调整
随着PD-1赛道日趋拥挤,相关企业纷纷调整战略。
国产PD-1单抗相继出海拓展新市场。如信达生物将中国区以外的所有权益授权给礼来,涉及金额为超10亿美元首付款/里程碑付款+两位数销售提成;百济神州将欧美大部分国家的权益授权给诺华,涉及金额为22亿美元首付款/里程碑付款+净销售20%~30%的特许使用费;君实将特瑞普利单抗和两个可选项目的美国和加拿大的权益授权给美国Coherus公司,金额为11.1亿美元的首付款/可选项目执行费/里程碑付款+两位数销售提成;恒瑞医药将韩国权益授权给CG公司,金额为近9000万美元的首付款/里程碑付款+10%至12%的销售提成。
与此同时,处于落后状态的药企也有宣布终止研发的。如百奥泰今年3月宣布终止BAT1306(即重组人源化抗PD-1单克隆抗体注射液)临床试验。在披露BAT1306项目终止原因时,百奥泰指出,从各家PD-1单抗的临床数据来看,预计未来2~3年,全球上市的PD-1产品可能超过20个。中国是PD-1竞争最激烈的地区,全球154个PD-1中85个由中国企业研发或合作开发,占比达到55%。PD-1单抗的研发赛道已经变得拥挤,繁多的研发竞品也加剧了对CRO公司的竞争,使得开发成本进一步加剧。
曾经的热门赛道PD-1/L1,未来会否成为避之不及的细分领域?
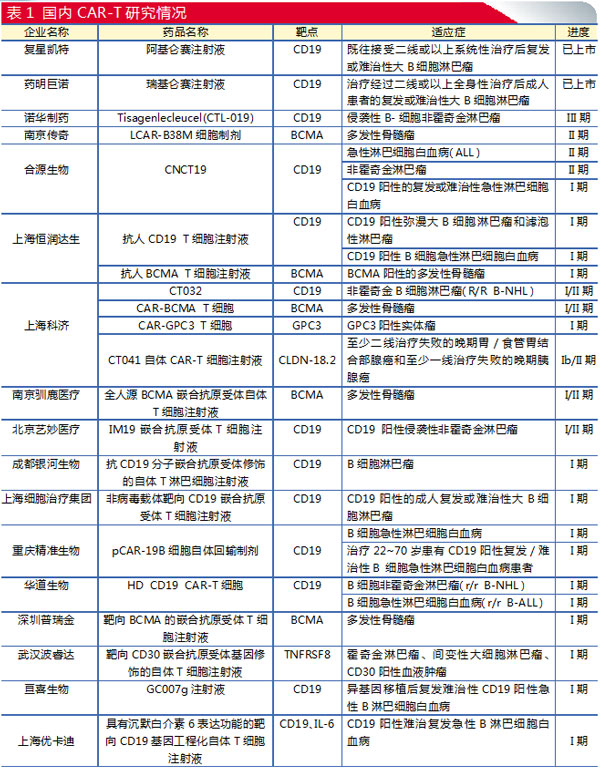
CAR-T:爆发在即,靶点同质化
中国已有2款产品上市
2021年6月和9月,两款CAR-T细胞疗法在国内相续获批上市:复星凯特的阿基仑赛注射液和药明巨诺的瑞基奥仑赛注射液。CAR-T细胞疗法也被认为是继PD-1/L1之后另外一个赛道拥挤的领域。
阿基仑赛注射液和瑞基奥仑赛注射液2款产品是通过与国内企业合资成立公司,进行技术引进合作开发快速进军中国市场的。
中国CAR-T疗法临床研究数量最多
从ClinicalTrials.gov上CAR-T细胞疗法临床试验注册登记数量的区域分布来看,中国已经超越欧美,成为当今世界上CAR-T细胞疗法临床研究数量最多的国家,不久的将来有望迎来多款CAR-T细胞疗法上市。
南京传奇独立研发的LCAR-B38M(cilta-cel)是一款靶向B细胞成熟抗原(BCMA)的CAR-T细胞疗法。2017年12月,强生旗下的杨森制药公司与南京传奇签订了一项全球独家许可和合作协议,以合作开发cilta-cel并将其商业化。2020年12月21日,杨森宣布开始向FDA滚动提交其研究药物B-ciltacabgene autoleucel(cilta-cel)用于治疗复发和/或难治性多发性骨髓瘤成年人的生物制品上市申请(BLA),已于2021年第一季度完成。
除了2019年12月在美国被授予的突破性疗法指定外,cilta-cel于2019年4月获得了欧盟委员会的优先药物(PRIME)指定,以及2020年8月在中国获得突破性疗法认定。杨森还于2019年2月和2020年2月分别获得了美国FDA和欧盟委员会的cilta-cel孤儿药认定。
2020年12月23日,合源生物科技(天津)有限公司CNCT19细胞注射液(抗CD19的CAR-T细胞疗法)在我国获准纳入突破性治疗药物,适应症为复发或难治性急性淋巴细胞白血病。该项目在国内正在开展Ⅱ期临床试验研究。
需要指出的是,CAR-T细胞疗法在激烈竞争中也出现了靶点同质化的问题。如研究热门的CD19靶点的CAR-T细胞疗法,患者基数相对较小、治疗市场有限,对于后续进入市场的企业来说将十分艰难。
赛道拥挤,出路在哪?
同质化问题突出
目前,从现有数据、业界思考以及监管机构的态度看,我国创新药开发赛道拥挤的问题日益突出。除了PD-1/L1和CAR-T之外,EGFR、VEGFR、CD20、TNF、BTK、JAK等靶点同样面临着竞争激烈的问题。
目前国内创新药产品(治疗领域和靶点)同质化问题较为突出。据悉,2018-2020年中国国家药品监督管理局(NMPA)批准的39个创新药中,First-in-class新药2个(5%);FDA批准的160个创新药中,First-in-class新药达到60个(38%);国内批准的新药治疗领域,除了抗肿瘤药物、抗病毒和抗感染以及镇痛药的比例与FDA批准的新药基本相似以外,其他领域并没有FDA覆盖的治疗领域多。
2020年,FDA批准的53款新药中,21个是抗肿瘤药,占比40%,另外31个(58%)为罕见病领域。我国对罕见病和儿童用药研发的关注度显然需要提高。
业界热议的PD-1单抗,就有276个注册受理号,申报企业42个;PD-L1单抗有148个注册受理号,申报企业29个。两者申请的适应症共涉及瘤种18个,肺癌有42家企业共计155个注册受理号。
对临床价值探索不够充分
国内多数创新药开发企业在开展临床前的药效学研究时,对于目标疾病的发病机制最新研究进展、流行病学、现有治疗手段及其优缺点等研究与分析不足。
在临床研究方面,对临床价值的探索和确定,应该提供全面的支持和证据。比如在探索性临床研究阶段时,缺乏对早期探索性临床研究重要性的认识,对关键性临床研究的支持性证据偏弱。
此外,对临床研究的规划和设计,多数企业更多出于临床注册的目的,而不是基于对临床价值的探索。
当前,需要坚持以患者为中心,以临床价值为导向,鼓励药物的创新和发展。
合作寻求价值
“临床价值”虽然对药品的临床研究和上市申请非常重要,但很多情况下是从产业和市场的角度判断一个药品能否具备投资意义。
临床价值高未必就一定意味着高商业价值。罕见病的药物开发,涉及非常少量的患者,即使临床价值等各方面都非常出众,但将其作为商业药物进行开发则会面临诸多挑战。
把药物选择完全交给市场无疑会造成很多浪费,包括临床资源、患者资源的浪费。单纯从商业化角度来说,众多产品进入竞争环节,对于市场、行业、社会等来说都将是巨大的浪费,也是不健康的发展。
因此,在市场、监管、支付等多方力量的影响下,并没有一个统一的界限来评估某个研发赛道是否过于拥挤,从而判断企业在药物研发资源的分配上是否需要调整。研发赛道是否过于拥挤?哪些地方存在错位竞争机会?更多是需要多方力量联合摸索。 我国目前已从仿制药向创新药转型。从近年国内企业的新药对外许可金额屡创新高可以说明,中国的创新从质量上已经开始逐步和国际接轨。至少在一些细分领域,我国与国际先进水平的差距正在进一步缩小。中国创新药的量变或许正在引起质变,届时才会成为赛道的领航者。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






