集采规则新方向 立项抢位第一批“唯快不破”
发布时间:2021-11-17 15:06:25作者:本报特约撰稿 边界来源:医药经济报
集采规则新方向
立项抢位第一批“唯快不破”
2021年11月的两则公告,对化学仿制药和生物类似药的市场影响很大,而国内企业的产品立项思维也将随之改变。
这两则公告分别是:国家医疗保障局办公室发布《关于做好国家组织药品集中带量采购协议期满后接续工作的通知》,以及国家组织药品联合采购办公室关于发布《全国药品集中采购文件(胰岛素专项)(GY-YD2021-3)》的公告(国联采字〔2021〕3号)。
A
化学药仿制药
立项要快,研发速度更要快
根据《关于做好国家组织药品集中带量采购协议期满后接续工作的通知》,国家组织集采药品协议期满后,通过询价、竞价、综合评价等方式确定中选企业和中选价格。
何时询价?价格基线、上限?
集采到期后第一步是优先与原中标企业询价:上一轮集采时差额中选的品种,原则上在稳定价格水平和临床用药的基础上开展询价。所在省上一轮中选价格不高于全国最低中选价1.5倍的,以所在省上一轮中选价格为基线向所有符合条件的企业开展询价;所在省上一轮中选价格高于全国最低中选价1.5倍的,以不高于全国最低中选价1.5倍为基线向所有符合条件的企业开展询价。询价上限为上一轮全国最高中选价。可根据企业报价意愿,结合对企业及其产品的综合评估结果,确定中选企业和中选价格。
利好集采开展时已获批厂家
这意味着能够参与国家集采的厂家将拥有先发优势,利好于国家集采开展时已获批的厂家。这些厂家通常就是排在前面获批的,化学药仿制药获批越快,越有望挤进国家集采。
对询价未成功,或者上一轮集采时等额产生中选结果,或者当前市场中已有非中选产品实际销售价明显低于上一轮集采本省最低中选价且有实际供应的,可通过竞价方式重新产生中选企业和中选价格。需求量较大或供应保障要求较高的省,鼓励同一品种由多家企业中选,不同中选企业的价格差异应公允合理。按照量价挂钩原则,明确各中选企业的约定采购量。
集采后才获批的竞价机会?
在国家集采后才获批的仿制药企业,争夺市场的机会只有在——全国最低中选价1.5倍价格下原中选企业不愿意续约,市场中已有非中选产品实际销售价明显低于上一轮集采本省最低中选价且有实际供应的,采购需求量较大的省份(通常会发生在广东、北京和上海等地),以及原中选企业信用、履约情况差从而被暂停其参加接续的资格——上述四种情况下,国家集采后才获批的仿制药才有望获得竞价。
事实上,对于没有赶在国家集采获批的厂家来说,只有“市场中已有非中选产品实际销售价明显低于上一轮集采本省最低中选价且有实际供应的”这种情况是相对可控的。这意味着生产厂家立项之前就有考量:必须选择价格非常有空间、且有一定技术难度、参与玩家尽量在5家左右的产品。
B
生物类似药
新上市“玩家”不能“不劳而获”
《全国药品集中采购文件(胰岛素专项)(GY-YD2021-3)》日前正式公告,意味着第六批集采开标。
赶在报量前获批上市的必要性
胰岛素是按厂家报量的。这意味着,如果没有赶在报量前获批上市的新获批产品,将得不到报量机会。以东阳光为例。2021年10月26日,东阳光才获批了甘精胰岛素注射液。早在2021年9月10日,国家组织药品联合采购办公室发布《关于第六批国家组织药品集中采购(胰岛素专项)相关企业及产品清单的公示》,9月13日公示结束后,国家组织药品联合采购办公室组织医疗机构按清单填报需求量。由于公示的目录没有东阳光的产品,11月5日发布全国首年采购需求量就没有东阳光的产品。
生物类似药,获批时间需再前移
由此可见,对于生物类似药而言,想要获得市场,获批时间要比化学仿制药更为前移,要在医疗机构报量前就要获批。
而且,鉴于“空白产品”推动医疗机构报量需要一定的推广时间,实际上,生物类似药越早获批、推广做得越好,在报量上会更有优势。
中选产品的分类、报量规则
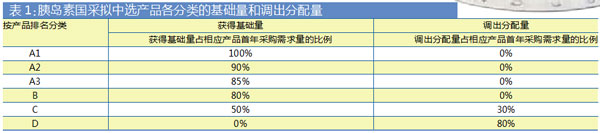
拟中选产品根据排名确定分类,分为A、B、C三类。个别采购组根据中选产品中的排名,前列的为A类,排名序号再额外标注。例如预混胰岛素类似物采购组,中选产品中排名第一、第二的产品为A类(分别标注为A1和A2)。
符合申报资格但未申报或未中选的产品为D类。如果D类的产品超过一定额度,则该采购组没有C类,其余中选产品均为B类。若同采购组内无D类产品,则中选产品中排名末尾的1家(或2家)的产品为C类,其余中选产品为B类。
A类、B类、C类的分类决定了生产厂家最终获得的量。
中选产品的协议采购量分三步确认。
第一步获得基础量:同采购组内,各产品根据排名和分类,分别按其首年采购需求量的一定比例,确定获得基础量以及调出分配量。
第二步调出分配量:调出分配量包括C类中选产品首年采购需求量的30%和D类产品首年采购需求量的80%,由医疗机构按要求进行自主选择。
第三步获得分配量:同采购组内,医疗机构自主选择调出分配量,C类中选产品的调出量分配给A类中选产品,D类产品的调出量分配给A类和B类中选产品。
规则不利于未在临床应用的厂家
以东阳光为例,甘精胰岛素注射液属于基础胰岛素类似物。若同采购组内无D类产品,则中选产品中排名末尾第一、第二的产品为C类,其余中选产品为B类;若同采购组内D类产品数为1个,则中选产品中排名末尾第一的为C类,其余中选产品为B类;若同采购组内D类产品数为2个及以上,则该采购组没有C类,其余中选产品均为B类。
从上述规则可以看出,东阳光可以抢的市场有以下三种情况:
①2家C类企业调出的30%,但东阳光必须前三中标。
②1家C类企业调出的30%,1家D类企业调出的80%,这要求东阳光必须前三中标并且知道哪家企业没有报名以及相关的医疗机构名单,并且医疗机构愿意将调出量分配给东阳光。
③2家及以上的D类企业调出的80%,同样要求东阳光必须得到未报名企业对应的医疗机构分配才能获得量。
综上所述,规则非常不利好于没有在临床获得应用的厂家。也就是说,生物类似药的集采规则没有像化学仿制药那样中标就可以“不劳而获”。这大概与生物类似药之间的相互替代目前还存在争议有关。
展望>>
天下武功,唯快不破。
无论化学药仿制药还是生物类似药,未来如何抢到相关品种的第一批集采(即国家集采)的时间点变得非常重要。这意味着企业一旦识别到市场机会,就要加快立项,而且还要拥有高效率的研发团队,才能确保在集采门槛(国内上市3家,化药仿制药需要通过或视同一致性评价)达成前获批。如果企业的研发团队效率不高,那么只能从成本中寻找机会。
生物类似药的厂家,除了追求快,还要考虑如何在上市后尽快打开市场,被医疗机构认可,才有可能在集采中获得更多的量。这也意味着生物类似药的立项不仅仅要考虑研发团队的效率,同样也要考虑团队的营销实力。对于初创企业来说,营销外包可能是一个好的选择。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






