抗菌药研发“小繁荣” 5年9款新药剑指哪些需求?
发布时间:2021-10-25 14:53:10作者:伊瑶来源:医药经济报
近年来,由于抗生素滥用和微生物进化导致多重耐药生物(MDRO)的出现,因而寻找有效且安全的新型抗生素的需求很大。然而,抗生素开发面临多项科学和经济挑战,生物制药行业支持新型抗生素开发的主要障碍是投资回报低。
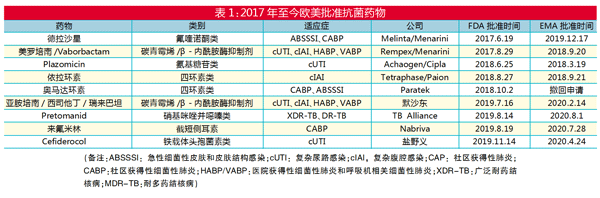
可喜的是,抗生素药物的开发取得了积极进展。2017年至2021年10月,共有9款抗菌药物在欧美获得监管机构批准,部分产品已通过在中国的合作伙伴提交了上市申请。
焦点1:哪些适应症、哪些机制受关注?
Plazomicin(氨基糖苷类)
[适应症] 复杂尿路感染(cUTI)
Achaogen/Cipla开发的Plazomicin(商品名为Zemdri)是一种新型氨基糖苷类抗生素,美国食品药品监督管理局(FDA)于2018年6月25日和欧洲药品管理局(EMA)于2018年3月19日批准用于治疗cUTI。Plazomicin与30S核糖体亚基结合并以浓度依赖性方式抑制蛋白质合成。Plazomicin对产生超广谱β-内酰胺酶(ESBL)的肠杆菌科、碳青霉烯耐药菌(CRE)、耐甲氧西林金黄色葡萄球菌(MRSA)和产生氨基糖苷修饰酶的生物具有活性。
一项Ⅲ期随机试验在609名患有cUTI或急性肾盂肾炎的成人患者中比较了Plazomicin和美罗培南。Plazomicin组与美罗培南组在治愈测试(TOC)就诊时的微生物根除率更高(81.7%对70.1%)。在Ⅲ期开放标签、非劣效性(CARE)试验中,39名因CRE导致血流感染、成人医院获得性细菌性肺炎(HABP)或呼吸机相关细菌性肺炎(VABP)的成人接受了Plazomicin治疗,Plazomicin组第28天的全因死亡率或显著并发症患者为23.5%,而粘菌素组为50%。
2020年2月,四环医药控股集团有限公司宣布,该公司已从美国制药公司Achaogen收购了Zemdri(Plazomicin)在大中华区(大陆、香港、澳门、台湾)的所有权益及知识产权。
Cefiderocol(铁载体头孢菌素类)
[适应症] 复杂尿路感染(cUTI)
盐野义开发的Cefiderocol(商品名为Fetcroja)是一类对产碳青霉烯酶革兰氏阴性菌(CRE、CRPA和CRAB)、MDRS、嗜麦芽菌和伯克霍尔德菌以及产ESBL和MBL的生物体具有活性的铁载体头孢菌素类药物。
2019年11月14日,该药获FDA批准用于易感革兰氏阴性微生物引起的cUTI(包括肾盂肾炎);2020年4月24日,该药获EMA批准用于需氧型革兰氏阴性菌引起的感染。
一项Ⅲ期试验(APEKS-NP)在300名患有医疗保健相关性肺炎(HCAP)、HABP或VABP的成人患者中比较了Cefiderocol与美罗培南,第14天的全因死亡率分别为12.4%和11.6%。另一项正在开展的Ⅲ期试验(CREDIBLE-CR)在150名患有由耐碳青霉烯革兰氏阴性病原体引起的HAP、VAP、HCAP、cUTI或BSI/败血症的成人中比较头孢地考与最佳可用疗法。
依拉环素(四环素类)
[适应症] 复杂腹腔感染(cIAI)
Tetraphase/Paion开发的依拉环素(商品名为Xerava)是一种新型四环素类,通过与30S核糖体亚基结合来抑制细菌蛋白质合成。FDA于2018年8月27日和EMA于2018年9月21日批准用于治疗成人复杂的腹腔内感染(cIAI)。
依拉环素克服了四环素外排和核糖体保护机制。依拉环素对MRSA、VRE、ESBL肠杆菌、鲍曼不动杆菌和CRE有活性,但对铜绿假单胞菌和伯克霍尔德菌没有活性。在Ⅲ期随机双盲(IGNITE1)试验中,在改良意向治疗(mITT)人群显示依拉环素组的临床治愈率为87%,而厄他培南组为88.8%。依拉环素组的微生物治愈率为91.4%,而厄他培南组为95%。在另一项Ⅲ期试验IGNITE 4中,依拉环素组和美罗培南组的临床治愈率分别为90.8%和91.2%。
云顶新耀从Tetraphase制药公司(现为La Jolla制药公司的全资子公司)授权引进Xerava,正在国内上市申请中。
来氟米林(截短侧耳素)
[适应症] 社区获得性细菌性肺炎(CABP)
Nabriva公司开发的来氟米林(商品名为Xenleta)是一种新型截短侧耳素抗生素,分别于2019年8月19日获FDA、2020年7月28日获EMA批准用于CABP。
来氟米林通过抑制50S细菌核糖体来抑制蛋白质合成,对肺炎链球菌、MRSA、VRE、MDR淋病奈瑟菌、肺炎衣原体、肺炎衣原体、肺炎支原体和流感嗜血杆菌具有活性。
在Ⅲ期临床试验(LEAP-1)中,来氟米林在551名CABP成人患者中不劣于莫西沙星,早期临床反应率分别为87.3%与90.2%。来氟米林组的停药率为2.9%,莫西沙星组为4.4%。另一项Ⅲ期临床试验(LEAP-2)在738名CABP患者中比较了口服来氟米林与莫西沙星,来氟米林的CABP(90.8%对90.8%)、临床反应率(87.5%对89.1%)和临床可评估人群(89.7%对93.6%)不劣于莫西沙星。
上海仑胜医药于2018年以超1亿美元的价格获得Lefamulin的大中华区权益,住友制药于2021年5月从仑胜医药接手了Lefamulin的大中华区权益。
Pretomanid(硝基咪唑并噁嗪类)
[适应症] 高度耐药结核病
非营利药物研发组织TB Alliance(全球结核病药物开发联盟)开发的Pretomanid(商品名为Pretomanid/Dovprela)是一种硝基咪唑并噁嗪抗生素,2019年8月14日和2020年8月1日分别获FDA和EMA批准用于用于药物不耐受或无应答的XDR-TB或MDR-TB(统称为“高度耐药结核病”)的治疗。
Pretomanid表现出对复制和静态结核分枝杆菌的杀菌活性。在Ⅲ期试验中,Nix-TB入组了109例XDR-TB以及药物不耐受或非反应性MDR-TB患者。数据显示,接受该药与贝达喹啉(Bedaquilin)和利奈唑胺(Linezolid)组成的三药“BPaL”方案治疗6个月并在完成治疗后随访6个月,前107例患者中有95例患者取得了治疗成功(临床感染得到解决、TB痰培养呈阴性)。有2例患者治疗时间延长至9个月。
2020年1月21日,TB Alliance授予上海复星医药(集团)股份有限公司全资子公司沈阳红旗制药有限公司在中国境内销售pretomanid的许可。
焦点2:碳青霉烯/β-内酰胺酶抑制剂,强大“适应症延展”类别
美罗培南/Vaborbactam
[适应症] cUTI、cIAI、HABP、VABP
Rempex/Menarini公司开发的美罗培南/Vaborbactam固定组合(商品名为Vabomere/Vaborem),于2017年8月29日被FDA批准用于治疗包括肾盂肾炎在内的复杂尿路感染(cUTI),并于2018年9月20日被EMA批准用于治疗包括肾盂肾炎在内的cUTI、复杂腹腔感染(cIAI)、医院获得性细菌性肺炎(HABP)、呼吸机相关细菌性肺炎(VABP)。
Vaborbactam没有任何抗菌活性,其主要功能是保护美罗培南免受β-内酰胺酶尤其是肺炎克雷伯菌碳青霉烯酶(KPC)的降解。在针对cUTI的Ⅲ期随机临床试验(TANGO I)中,美罗培南/Vaborbactam和哌拉西林/他唑巴坦相比,前者总体成功率更高(98.4%对94%)。在碳青霉烯类耐药肠杆菌科(CRE)确诊或疑似感染的成人患者Ⅲ期随机临床试验(TANGO II)中,美罗培南/Vaborbactam与最佳可用疗法相比,前者获得了更高的临床治愈率,治疗结束时的微生物学治愈率没有差异,第28天的死亡率没有显著差异(15.6%对33.3%)。不过,美罗培南/Vaborbactam的不良事件较少(84%对92%)和肾脏不良事件较少(4%对24%)。
亚胺培南/西司他丁/瑞来巴坦
[适应症] cUTI、cIAI、HABP、VABP
默沙东开发的亚胺培南/西司他丁/瑞来巴坦(商品名为Recarbrio)是亚胺培南、肾代谢抑制剂西司他丁和瑞来巴坦(一种β-内酰胺酶抑制剂)的固定组合,于2019年7月16日被FDA批准用于治疗由某些易感革兰氏阴性菌引起的复杂尿路感染(cUTI,包括肾盂肾炎)和复杂腹腔感染(cIAI),并于2020年2月14日被EMA批准用于治疗成人医院获得性细菌性肺炎(HABP),包括呼吸机相关细菌性肺炎(VABP)。
瑞来巴坦对A类(包括ESBL和KPC)和C类(AmpC)β-内酰胺酶有活性,也对产ESBL的肠杆菌、KPC、CRE和可能的耐碳青霉烯的铜绿假单胞菌有活性。
RESTORE-IMI 1是一项Ⅲ期随机试验,在47名由革兰氏阴性亚胺培南耐药菌引起的HAP/VAP、cIAI和cUTI的成人患者中,亚胺培南/西司他丁/瑞来巴坦或粘菌素碱活性(CBA)/亚胺培南/西司他丁总体缓解率类似(分别为75%和76.9%)。
RESTORE-IMI 2试验是一项在536名HAP/VAP成人患者中比较亚胺培南/西司他丁/瑞来巴坦与哌拉西林/他唑巴坦的Ⅲ期临床试验,所有患者均接受利奈唑胺治疗。在比较28天全因死亡率中,亚胺培南/西司他丁/瑞巴坦不劣于哌拉西林/他唑巴坦(15.9%对21.3%),并且在早期表现出良好的临床反应(61.0%和55.8%)。
焦点3:不同机制,聚焦2个相同适应症(CABP、ABSSSI)
德拉沙星(氟喹诺酮类)
Melinta/Menarini公司开发的德拉沙星(商品名为Baxdela/Quofenix)是一种新型阴离子氟喹诺酮类抗生素,分别于2017年6月19日和2019年12月17日获得FDA和EMA批准用于治疗急性细菌性皮肤和皮肤结构感染(ABSSSI)。今年6月,新适应症由指定的易感细菌引起的社区获得性细菌性肺炎(CABP)成人患者获得FDA批准。
与其他氟喹诺酮类药物相似,德拉沙星具有浓度依赖性抗菌活性。德拉沙星对肺炎链球菌和金黄色葡萄球菌(包括MRSA)的最低抑菌浓度(MIC)较低,一些耐左氧氟沙星的肺炎链球菌菌株对德拉沙星敏感。德拉沙星对铜绿假单胞菌、厌氧菌和非典型生物也有活性。
在ABSSSI的Ⅲ期多中心、双盲、随机试验研究中,德拉沙星被证明不劣于万古霉素加氨曲南。而在一项Ⅲ期、多中心、随机试验(DEFINE-CABP)中,将德拉沙星在社区获得性细菌性肺炎(CABP)中的疗效和安全性与莫西沙星进行了比较,结果显示,每组的早期临床反应相似,约为89%。
奥马达环素(四环素类)
Paratek公司开发的奥马达环素(商品名为Nuzyra)是一种四环素抗生素,于2018年10月2日被FDA批准用于治疗CABP和ABSSSI。奥马达环素通过四环素外排和核糖体保护机制克服了耐药性,并具有抗嗜肺军团菌、肺炎支原体和肺炎衣原体的活性。因此,奥马达环素可以作为β-内酰胺和大环内酯的经验组合的替代方案,单一药物用来治疗CABP。
2019年10月17日,EMA已经完成该药上市申请评估,并考虑仅推荐对ABSSSI进行营销授权。Paratek表示,将Nuzyra仅用于治疗皮肤和皮肤结构感染在商业上不可行进而撤回上市申请。
在一项Ⅲ期随机对照试验(OPTIC)中测试了奥马达环素的有效性和安全性,该试验在386名CABP患者中比较了奥马达环素和莫西沙星,然后是口服奥马达环素或莫西沙星。奥马达环素组的早期临床反应率为81.1%,而对照组为82.7%。在治疗后评估中,奥马达环素的临床缓解率为87.6%,而莫西沙星组的临床缓解率为85.1%。奥马达环素的不良事件为5.5%,而莫西沙星为7%。
奥马达环素或利奈唑胺的Ⅲ期随机对照(OASIS-1)试验中,在316名ABSSSI患者中测试了奥马达环素,随后口服奥马达环素或利奈唑胺。在MITT中,与利奈唑胺相比,早期反应率分别为84.8%和58.5%。奥马达环素对MRSA的临床反应率为83%,而利奈唑胺组为86%。奥马达环素组的不良事件为18%,而利奈唑胺组为18.3%。
2017年4月,再鼎医药与Paratek制药达成合作,获得奥马达环素在中国的独家开发及商业化许可(研发代码为ZL-2401),目前本品已在国内提交上市申请。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






