化学仿制药注册申报创新高 新三类何时豁免临床备受关注
发布时间:2021-10-11 11:00:53作者:本报特约撰稿 边界来源:医药经济报
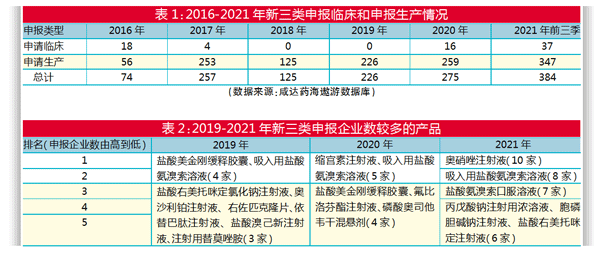
2021年,化药仿制药申报创下新高。第三季度还没结束,新三类(仿制境外上市但境内未上市原研药品的药品)和新四类(仿制境内已上市原研药品的药品)的注册申报数量就已经超过2020年全年的受理号数。
以新三类为例,2020年新注册法规发布后,新三类又恢复了需要做临床的先申报临床然后再报产的程序。2021年前三季度,新三类的申报临床和生产数量已经超过2020年同期。由此可见,仿制药的申报正在回暖。
趋势
早期申报新三类企业进入收获期
2021年产品申报新三类临床最多的企业是扬子江,申报了注射用卡非佐米、奥贝胆酸片、琥珀酸去甲文拉法辛缓释片、雷诺嗪缓释片、盐酸艾司氯胺酮注射液和注射用德拉沙星6个产品,合计7个受理号。
2016年申报新三类产品最多的企业是宜昌人福药业和齐鲁制药,分别申报了21个产品。
齐鲁制药已有9个新三类产品上市,分别是右佐匹克隆片、曲氟尿苷替匹嘧啶片、阿立哌唑口崩片、来氟米特片、注射用比阿培南、注射用福沙匹坦双葡甲胺、酒石酸溴莫尼定滴眼液、注射用比伐芦定和恩曲他滨胶囊。此外,齐鲁制药(海南)还申报了5个产品,奥沙利铂注射液和左西孟旦注射液获批上市。
宜昌人福药业已有5个新三类产品上市,分别是盐酸安非他酮缓释片、盐酸阿芬太尼注射液、氯化钾缓释片、咪达唑仑口服液和盐酸二甲双胍缓释片。
正大天晴药业集团申报14个新三类产品的生产,南京正大天晴制药申报了9个新三类产品的生产。正大天晴药业集团的艾司奥美拉唑镁肠溶胶囊、泊马度胺胶囊、曲氟尿苷替匹嘧啶片、注射用盐酸苯达莫司汀、注射用阿扎胞苷和磷丙替诺福韦片已获批上市。南京正大天晴制药的盐酸右美托咪定注射液和索磷布韦片已获批上市。
早期申报新三类的企业已经进入收获期。
早期热门产品VS近期热门产品
产品方面,申报临床的产品如果有两家企业申报,已经算热门产品。2021年申报的最热门产品是奥贝胆酸片和注射用德拉沙星。
2016年以来,申报新三类生产厂家超过10家的产品有吸入用盐酸氨溴索溶液、奥硝唑注射液、盐酸右美托咪定注射液。
口服溶液和和注射剂是近期新三类申报的大热产品,但自2021年9月以来,这两类的个别产品的申报结果未获批准,业界普遍认为是因为这些项目没有启动临床研究。
解惑
新三类的申报是否需要做验证性临床已经引起业界关注。而事实上,新三类是否需要做临床也一直是让企业纠结的谜。
不需要做临床上市的案例:奥沙利铂注射液
在仿制药参比制剂目录(第二十七批)(2020年第30号)里,注射用奥沙利铂的参比制剂是原研Sanofi-Aventis France(赛诺菲)的50mg国内上市的原研药品;但是,在《化学仿制药参比制剂目录(第四十六批)(征求意见稿)》的“已发布化学仿制药参比制剂调出品种目录”中,却要剔除原研赛诺菲的参比制剂地位,理由是“经一致性评价专家委员会审议,拟调出参比制剂因采用终端灭菌工艺制备的奥沙利铂注射液可以满足产品杂质控制及稳定性要求,奥沙利铂注射剂应首选终端灭菌的注射液,注射用奥沙利铂为不合理剂型,予以调出”。目前第四十六批参比制剂的正式稿尚未公布。
国家药监局关于发布仿制药参比制剂目录(第二十九批)的通告里公布了奥沙利铂注射液的参比制剂为齐鲁制药的200mg/40ml,理由是国际公认的同种药品(美国橙皮书)。但是,在《化学仿制药参比制剂目录(第四十三批)(征求意见稿)》却否了齐鲁制药的50mg/10ml,理由是“经一致性评价专家委员会审议,拟申请参比制剂为美国上市的仿制药,不具有参比制剂地位,审议未通过”。
目前国内通过一致性评价的奥沙利铂的注射剂都是奥沙利铂注射液,生产企业分别有齐鲁制药、江苏恒瑞、四川汇宇和山东新时代,都是2020年以后上市(以新三类申报上市),视同通过一致性评价。齐鲁制药、江苏恒瑞、扬子江、江苏奥赛康和杭州中美华东都申报了注射用奥沙利铂的一致性评价,但暂无厂家获批一致性评价。
注射剂是否都不需要做临床?
已上市的厂家基本都做了验证性临床,有厂家没做所以没获批的注射剂产品有:盐酸右美托咪定注射液、格隆溴铵注射液、氟比洛芬酯注射液和泊沙康唑注射液。
全部厂家做验证性临床才获批上市的注射剂产品有:布洛芬注射液、注射用福沙匹坦双葡甲胺。
全部厂家做了BE但没做验证性临床获批上市的注射剂产品有:注射用替莫唑胺、左乙拉西坦注射液。
全部厂家没做验证性临床也获批上市的注射剂产品有:盐酸溴己新注射液、克林霉素磷酸酯注射液、硫酸特布他林注射液、左西孟旦注射液和注射用右雷佐生等。这些不需要做临床的产品都有一个特点,就是国内仿制药厂家已经在国内上市多年。
缬沙坦口服溶液是否需要做临床?
口服溶液通常是不需要做生物等效性研究,如果同适应症的口服通用名的固体制剂产品已上市,理论上是不需要做验证性临床的。于是,近几年口服溶液因为投入少而受到企业的关注,例如恩替卡韦口服液、地氯雷他定口服溶液、盐酸美金刚口服溶液、盐酸左西替利嗪口服液和盐酸普萘洛尔口服液等口服溶液剂,都是直接申请豁免临床研究上市的。
然而,缬沙坦口服溶液剂因为没有做验证性临床导致不予批准引起行业的关注。
缬沙坦口服溶液剂是2019年发布的《第三批鼓励研发申报儿童药品清单》内的产品。
2020年常州四药和广州一品红分别申报缬沙坦口服液,都没有启动临床研究。2021年9月常州四药的受理不予批准,广州一品红的受理为暂停状态。
缬沙坦片剂已经上市多年,缬沙坦口服溶液为何要做临床?行业对此有两种看法:
一种看法是:缬沙坦口服溶液剂这类剂型此前无厂家上市,剂型首次上市需要做验证性临床。同样的情况有呋塞米口服液和马来酸依那普利口服液。但是,仍存在反面案例——普瑞巴林口服液。
第二种看法是:缬沙坦的固体制剂没有儿童适应症,缬沙坦口服溶液剂有儿童适应症,新适应症上市所以要做验证性临床。呋塞米口服液和马来酸依那普利口服液预计也符合此情况,两者都分别列入了《首批鼓励研发申报儿童药品清单》和《第三批鼓励研发申报儿童药品清单》。
结语<<<
鉴于目前对于不批准的产品CDE通常不会发布原因,企业需要分析推测哪些类型的新三类产品不需要做验证性临床。
此外,儿童适应症一般是成年人的适应症再倒推。如果原研药获批儿童适应症,那么新三类需要做的研究具体是哪些?是否应该是儿童的人种差异呢?
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






