亚太地区监管协调进程的中国启示
发布时间:2021-10-09 16:32:07作者:袁华庚 张黎来源:医药经济报
9月23-26日,第十二届中国医疗器械监督管理国际会议(CIMDR)在武汉举办。本次会议上,监管科学继续成为行业关注的热点话题,多位海内外专家围绕该话题作了分享。
随着生物技术、纳米技术、细胞和基因疗法以及数字医疗等新技术的涌现,医疗产品更加复杂和多样化。对于单个监管机构而言,运用专业知识评估不同技术是一项巨大挑战。新冠疫情全球大流行凸显了提高医疗产品可及性的必要性,也使监管机构更加意识到:在资源有限的情况下,只有通力合作,才能以更加高效的方式,在不影响质量、安全和有效性的前提下实现医疗产品的快速可及。
【定义】
监管依赖成未来发展路径
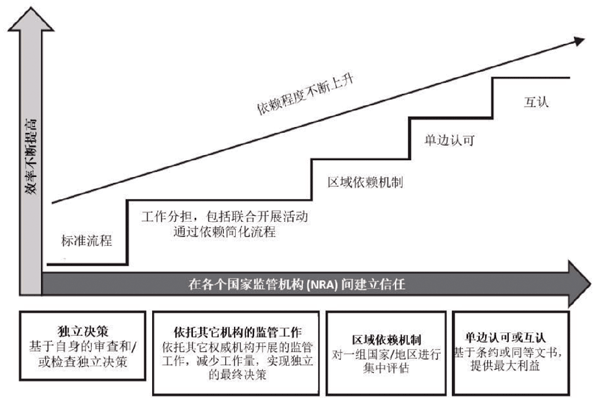
监管依赖是指一个监管机构(“依赖机构”)完全或部分依靠其他市场或WHO这样的权威组织制定的评估和/或决策对医疗产品进行审批。WHO在《医疗产品监管的良好依赖实践:高层级原则与考虑》中对监管依赖概念进行解释(参考上图)。
监管依赖的最基本形式是,利用另一监管机构已完善的工作来协助决策的制定,同时也保持其对医疗产品审批的独立性。更高级的依赖形式是,基于互认条款等协议,不重复评估,即正式接受另一监管机构的决策。
WHO建议建立一套对监管依赖实践的管理原则——保证决策自主性,尊重国家和区域法规,具备胜任力、普适、透明、连贯的原则。特别强调的是,监管依赖并不要求“依赖机构”出让自己的独立管辖权。
是否需立法改革?
虽然最好的做法是通过立法来鼓励实施监管依赖,但在无法律禁止的前提下,各国应有权自主选择是否采取这一方式。美国国家科学、工程和医学研究院2020年3月发布的共识调查报告——《全球化之下的医药管理:增强监管机构间的依赖》(2020)解释:依赖明显属于以下两类情况的第二类,不需要立法改革。
1.认可:一个司法管辖区的监管机构常规上接受另一监管机构或其他权威机构的工作成果及监管决策。“认可”意味着,符合A国监管要求的证据足以满足B国的监管要求。尽管“认可”通常表现为互认协议,其实也可以有单边、双边及多边的形式。
2.依赖:一个司法管辖区的监管机构在决策过程中,考虑并重视另一监管机构或权威机构的工作成果。即使“依赖机构”依赖其他机构的决策和信息,它们仍对自己采取的决策负有责任。
第二类中,监管依赖意味着监管机构可以找到潜在有用的对象(例如,另一监管机构的评估报告),加速自身的审批程序,而无需等待正式立法批准接受另一监管机构的决策,同时,“依赖机构”对自己的决策负责。
【试点】
新加坡-泰国试点分两阶段
2020年9月,在亚太医疗技术协会(APACMed)的支持下,新加坡卫生科学局与泰国食品药品监督管理局联合启动了监管依赖试点项目。在新冠疫情爆发之前,泰国食药监局派员前往新加坡进行调研并熟悉有关评估流程。这个试点项目同时也有利于双方就有关医疗器械的类别加强信息交换和能力建设。
该试点的第一阶段于2020年9月实施,泰国食药监局基于“先到先得”的原则,提出接受12份申请。该试点对全行业开放,申请加入试点的资格须满足以下条件:分类为C级或D级的医疗器械;按泰国旧版法规注册的进口医疗器械可以重新提交注册(以加速现有医疗器械的重新评估,顺利过渡到2021年2月实施的新法规);已在新加坡卫生科学局注册的医疗器械。
第一阶段之后,泰国食药监局2021年2月宣布实施试点第二阶段,并基于“先到先得”原则同意接受12份申请。申请者应满足下述资格:分类为B级、C级或D级的医疗器械;除上述分级外,所申请的医疗器械须属于以下类别:新冠病毒检测试剂盒,活性植入物,自动体外除颤仪,含有动物细胞、组织和/或细胞、组织衍生品和/或微生物或重组来源的衍生品;已在新加坡卫生科学局注册的医疗器械。
节省时间和资源
该试点的预期产出是,相比常规申请路径,泰国食药监局对试点产品的审批时间将大为缩短。同时,由于试点项目节省了审评资源,申请费用也有望减少。
目前,第一阶段提交的申请已完成审评。根据泰国食药监管局今年2月实施的医疗器械新规,企业需要在新信息系统中重新提交资料,因此还需等待最终获批。根据APACMed会员企业及泰国食药监局的初步反馈,在监管依赖试点下,审评时间已从通常所需的十个月大幅缩短至两个月左右。而企业在新信息系统提交资料后,需要再等一个月才能获批,因此监管依赖试点下的总审批时长通常需要3个月。目前,正在开展试点第二阶段的文件提交工作。
试点的意义
从短期来看,试点将鼓励亚太地区监管机构更多地将“监管依赖”作为加速该地区医疗器械审批的办法;从中期来看,试点将搭建一个亚太地区广泛的合作和监管依赖网络。
据悉,APACMed正与其他监管机构紧密合作,共同探寻在亚太地区拓展监管依赖网络的可能性,即推动成为依赖机构或参考机构的可行性。在此期间,一些东盟国家药监机构已经表达了合作的意向,如今年4月,APACMed与菲律宾食品药品监督局举办了第一期介绍会;APACMed还与澳大利亚医疗用品管理局(TGA)开展多次研讨。另外,APACMed也正在与IMDRF、AHWP、WHO等国际机构开展讨论,探寻在监管依赖方面的合作机遇。
加强区域监管法规协调合作具有重要意义。2018年,国家药监局首次担任IMDRF轮值主席,深度参与国际监管标准制订,推动中国倡议的两个医疗器械项目立项。在当前IMDRF的成员单位中,澳大利亚、中国、日本、新加坡、韩国药监机构都属于亚太地区。密切关注在亚太地区的监管协调动向,有利于我国监管机构更好地参与国际规则制定,推动先进医疗技术更好更快地惠及患者。
(本文在撰写过程中参考了亚太医疗技术协会《亚太地区医疗器械监管依赖试点项目报告》)
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






