政府定价、不谈判 成本效果评价日本怎么做?
发布时间:2021-09-22 10:56:03作者:胡善联 复旦大学公共卫生学院教授来源:医药经济报
在日本,药品是由政府定价,药企不能自由定价。
政府定价若不适当,弊端是明显的:若政府定价过高,会增加公共财政的负担;若政府定价过低,药企就没有能力继续研究和开发新药。
因此,制定适宜的药价,才能有效利用公共资源,使卫生系统得到可持续发展。但是,如何才能保证政府定价恰到好处?
近期,国际药物经济学和结果研究协会(ISPOR)亚太地区举行的线上会议上,交流各国最新研究进展。日本Takashi Fukuda教授介绍了日本成本效果评价体系的情况。笔者综述如下,以飨读者。
Why-What-How
医疗费用负担沉重,定价适宜很重要
日本的医疗费用主要是由医疗保险的保费和税收来支付,患者个人支付比例一般为医疗费用的30%。如果医疗费用超过个人医疗费用30%的共付封顶线(copayment),超过的医疗费用个人只需再负担其中的1%。
但是,随着日本人口老龄化和医疗技术的发展,卫生费用不断上升,2018年日本卫生总费用已达42兆日元。2017年财政年度,日本医疗费用为16兆日元,相当于1500亿美元,约占40%的全国卫生总费用。在这16兆亿日元中,中央政府支付11兆日元(约1000亿美元),其余由地方政府支付。医疗费用的预算远高于公共建设费用的预算(6兆日元)和教育费用的预算(5兆日元)。
因此,日本卫生保健需要在成本和结果之间取得平衡。
在日本,药企不能自由定价药品,药价是由日本厚生省根据中央社会保险医学委员会(Chuikyo)的建议决定的。该组织由医疗保险部门、患者、工会、医生、药剂师和中立的公共部门代表组成,根据各自的立场来讨论适宜的定价。
建立成本效果评价体系:两种定价模式
日本健康结果研究和经济评价中心负责成本效果评价过程。该中心简称为“C2H”(Core 2 Health),是日本国立公共卫生研究院(NIPH)中的一个公共研究组织。2H最早是指经济评价的2E(Economic Evaluation),提供以循证为基础的卫生政策。
进行药品或医疗器械评价时,企业通常支付30%的评价费用,其余70%费用由医疗保险费用和税收来支付。
对药品和医疗器械开展成本效果评价,最初由日本政府内阁于2015年6月提出,2016年试行,到2019年才正式成立评价系统。C2H组织和提供成本效果评价的过程和方法。
日本药品的定价模式基本有两种方式:
一是“类似功效的比较方法”(similar efficacy comparison method)。这一方法将新药的价格与已经存在的类似药物或医疗器械为基础的价格比较。假如一个已有的类似药物为100日元,则新药也定价为100日元。如果新药的评价优于已有的这类药物,则通常可加价10%。但是,如何判定其优越性(superiority)以及价格增加的幅度应该多少,仍是值得探讨的问题。
另一种方法是“成本计算的方法”(cost calculation method),也称为“成本加成的方法”(cost plus method)。成本计算涉及药企的生产成本和利润。
新药评价的标准:升降的阈值是什么?
当新药产品得到批准上市后,需要根据最近的定价规则,经过成本效果评价后重新调整价格,才能在医疗保险获得报销。特别是那些期望年销售量高或特别高价的药品,需要进行评估。在日本,只有罕见病的孤儿药和儿童药才能豁免成本效果分析。
在新药评审中,如果新药的期望年销售峰值达到100亿日元(相当于9000万美元)或更高地达到150亿日元(1.33亿美元),都需要进行成本效果评价。
长期以来,日本成本效果的阈值设定为500万日元/QALY(相当于4.5万美元/QALY),只有抗癌药可以设定750万日元/QALY的较高阈值(约6.8万美元/QALY)。在日本,虽然没有政府价格谈判,但价格需要逐步下降。
另一方面,如果一个新药的成本效果评价具有绝对的优势,ICER值又低于200万日元(1.8万美元/QALY),则有可能提高该药品的定价标准,但不是所有这类药品均可加价。
指南看点
2019年日本中央社会保险医学委员会发布了成本效果的评价指南。内容包括目的、分析角度、目标人群、参照品、附加效益、分析方法、时间长度、健康结果测量的选择、临床数据的来源、医疗保健成本的测算、公共长期护理成本和生产力损失的测算、贴现、模型法、不确定性等14个章节。有些内容值得我国在当前药品谈判中参考。
参照品选择原则
参照品一系列的选择原则包括:①选择今后有可能被替代的药物;②选择已被社会保险列入补偿的药品;③如果不能确定单一参照品,可考虑随机对照试验(RCT)中使用的对照药品或参考技术;④与药企协商确定参照品;⑤在参照品的选择上需要有充分的理由说明;⑥如果参照品在市场上已有仿制药,应该提交比较资料。
附加效益测定原则
在附加效益测定方面,提出PICO原则(Patient,Intervention,Comparator,Outcome)和研究设计的PRISMA原则(Preferred Reporting Items For Systematic Reviews and Meta-Analyses)与参照品比较;对RCT的系统文献回顾。在研究方法方面提出,当新药评审有多个适应症或亚组人群时,则分别计算各自的ICER值。
贴现率标准
在贴现率应用上,如果研究时长为一年或更短时间,则成本和效果均不需要贴现。如果需要贴现,采用2%的年贴现率标准,在敏感度测定时贴现率可设定在0~4%范围内。
模型法要求
在模型法内容中提出,所有参数和材料均需说明,而且需要提交电子版本,模型内容要易于被第三方专家理解。如果Markov周期过长,而且会影响到最后的结果,可以有半周期的更正(half-cycle correction)。此外,在概率敏感度(PSA)测定时,散点图和成本效果曲线(CEAC)必须显示。
CAR-T案例
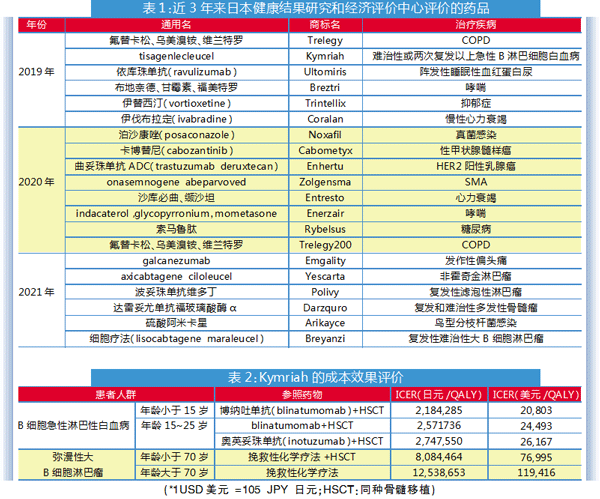
2019年、2020年和2021年6月前,日本已完成成本效果评价工作的新药数量分别为6、8、6个,共计完成20个新药的评审(见表1)。
多个适应症或亚组,分别计算ICER值
以CAR-T细胞免疫疗法Kymriah的成本效果评价为例。
Kymriah有两个适应症:一是复发和难治性CD19阳性B细胞急性淋巴性白血病(B-ALL),另一个是复发和难治性CD19阳性弥漫性大B细胞淋巴瘤(DLBCL)。
从2019年5月起,日本用成本计算法确定支付价为34,113,655日元。在药物经济学评价时,治疗人群按小于15岁及15~25岁年龄组患者,用blinatumomab+同种骨髓移植(HSCT)作为参照品,通过分区生存模型证明Kymriah具有附加效益。
但是,专家组认为单臂的JULIET临床试验样本数少,而且70岁以下患者被排除在外,用外推生存曲线的方法会高估治疗的结果,试验的年龄组与实际临床情况也有不同等问题,不确定性较大。经过重新测算后,获得了Kymriah成本效果评价的ICER值(详见表2)。
Kymriah降价4.3%,COPD和哮喘用药只降价0.5%
由于ICER结果部分已超越日本的ICER阈值,因此需要对Kymirah的价格进行调整。原始的价格为34,113,655日元(相当于324,892美元),经调整后价格为32,647,761日元(310,931美元),降价4.3%。最后,日本将Kymirah和Yescarta均定为降价4.3%。
而对治疗呼吸道疾病COPD和哮喘的药物,如Trelegy(氟替卡松、乌美溴铵、维兰特罗)、Trelegy200(氟替卡松、乌美溴铵、维兰特罗)、Breztri(布地奈德、甘霉素、福美特罗)、Enerzair(茚达格莫吸入粉雾剂),只降价0.5%。
日本药品价格调整的参考阈值为500万、750万和1000万日元。长期来看,如果ICER小于500万日元,药品的价格不会改变;若ICER值在500万~1000万日元,则根据ICER值大小而降价;若ICER值超过1000万日元,将根据最大调整率降价。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






