Jak抑制剂安全问题升级 谁将受益?
发布时间:2021-09-13 17:28:17作者:李勇来源:医药经济报
近日,FDA要求已获批用于治疗某些慢性炎症的Jak抑制剂在说明书中添加“增加严重心脏相关事件、癌症、血栓和死亡的风险”的黑框警告。预计这会在一定程度上抑制该类药物在临床上的应用,此次监管行动的力度也超出了业界预期。
FDA认为,托法替布(Xeljanz和Xeljanz XR)严重心脏事件风险的增加是一种类效应(Class Effect),其对这类药物在类风湿性关节炎中的使用限制,是针对TNF阻滞剂治疗失败的患者。
市场输家
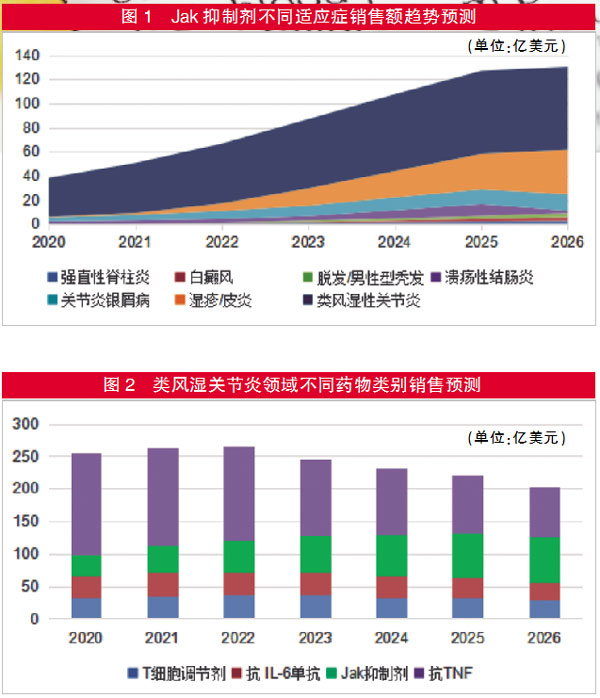
Jak抑制剂其它适应症审批存疑,销售前景下滑
FDA增加黑框警告的举动可能决定了Jak抑制剂未来的临床应用地位,这几乎排除了其未来进入更早治疗线的可能性,还将巩固抗TNF药物在类风湿性关节炎治疗中的主导地位。
值得注意的是,在针对Jak抑制剂更加严格的使用条件或批准次优剂量方面,FDA不会止步于类风湿性关节炎适应症。目前,还有Jak抑制剂在等待其他炎症性疾病(如银屑病关节炎和特应性皮炎)以及其它被认为不会受限的疾病(如脱发)的审评结果,不排除这些申请有被拒绝的风险。
不过,Evaluate Pharma预计,至少在2026年之前,Jak抑制剂仍将是类风湿性关节炎领域最畅销的药物类别之一。
然而,出于对FDA下一步行动的担忧,FDA宣布增加黑框警告的当天,艾伯维的市值蒸发了150亿美元。与此同时,Jak抑制剂的竞争产品或将成为潜在的受益者。
艾伯维或许是FDA这一决策的最大输家。Rinvoq是其主要的销售增长动力,此前有预测认为,到2026年,该药的年销售额将增至90亿美元,而类风湿性关节炎适应症预计将占其销售额的一半左右。尽管黑框警告目前仅限于美国,但这预计是Rinvoq利润最高的市场,占总销售额的三分之二。此外,Rinvoq在特应性皮炎、银屑病关节炎和强直性脊柱炎方面的上市申请屡遭FDA延迟审评。
辉瑞是另一个潜在的输家,该公司已将其Jak抑制剂abrocitinib的开发重点放在特应性皮炎上,FDA的审评决定也被延迟。此外,礼来的Olumiant用于重度特应性皮炎患者适应症的上市申请,也被FDA延迟审评了2次。
根据Evaluate Pharma此前的预测,到2026年,Jak抑制剂的销售额将接近150亿美元,现在看来这一数字不太可能成为现实。
潜在赢家
抗TNF药物、IL-23抗体面临的竞争威胁减弱
多年来,药企都想强调Jak抑制剂之间的差异,但FDA似乎并不买账。例如,艾伯维一直认为Rinvoq对Jak1的选择性使其比同时靶向于Jak2和Jak3激酶的分子更安全。
Tyk2抑制剂的开发者也在紧张地转移监管机构对Jak抑制剂安全性的担忧。作为同一家族,Tyk2被怀疑论者称为“第四个Jak”。目前,百时美施贵宝和辉瑞是Tyk2的主要布局者。
当前,艾伯维面临的难题是,是否应该尝试通过开展Rinvoq大型心血管结局研究来反驳监管机构的类效应说法。鉴于此举可能适得其反,且似乎不太值得冒险,该公司可能会考虑重新关注其另一个主要增长动力Skyrizi,这可能是一个更好的选择。
Skyrizi是一种抗IL-23抗体,这一类药物已被证明对银屑病非常有效,在炎症性肠病中也有很大的潜力。事实上,IL-23这种机制可能成为Jak抑制剂安全事件的受益者之一。其他IL-23参与者包括强生已获批上市的古塞奇尤单抗(Tremfya)和礼来在研的mirikizumab。
如果FDA推迟Jak抑制剂在特应性皮炎中的使用,赛诺菲和再生元的度普利尤单抗(Dupixent)所面临的竞争威胁也将减弱。
同时,抗TNF药物的制造商可以继续守住市场。这一领域的主导产品无疑是艾伯维的阿达木单抗(Humira),该药已经大大延迟了生物类似药在美国的上市进度,最早也要到2023年才会迎来竞争。而安进的依那西普(Enbrel)的生物类似药可能要到2030年才能进入市场。
新机制的开发者也可能从强大竞争对手的受挫中受益。其中包括Aclaris公司的MK2抑制剂,该药已在类风湿性关节炎中取得早期成功;Arena则希望其S1P调节剂etrasimod在未来几个月内对各种炎症性肠病产生积极结果。
观察<<<
新药安全性门槛提高?
制药界还在观察FDA对Jak抑制剂增加黑框警告的影响。在Leerink分析师看来,这一举动并不寻常,目前欧洲药监局(EMA)没有显示出限制Jak抑制剂使用的迹象。
FDA对于Jak抑制剂其它适应症的申请会作何决定尚未可知,但其似乎已经采取了非常谨慎的立场。Jak抑制剂的受限很可能会产生一些直接受益者,但那些新机制的开发者应该先确定FDA对新药的安全性门槛是否正在上升?目前似乎还没有明确答案。
☆☆★事件回顾★☆☆
9月1日,根据对一项大型随机安全临床试验的完整审查,美国FDA得出结论:关节炎和溃疡性结肠炎药物Xeljanz和Xeljanz XR(托法替布)心脏病发作或卒中等严重心脏相关事件、癌症、血栓和死亡风险增加。
该试验将Xeljanz与另一种用于治疗类风湿性关节炎患者的肿瘤坏死因子(TNF)阻滞剂进行了比较。该试验的最终结果还显示,较低剂量的Xeljanz也会增加血栓和死亡的风险。而该试验早期结果报告称,Xeljanz仅在较高剂量下才会出现血栓和死亡风险增加。
FDA要求对与Xeljanz属于同一药物类别(即Jak抑制剂)的另外两种关节炎药物——礼来的Olumiant(巴瑞替尼)和艾伯维的Rinvoq(乌帕替尼),发布新的安全性警告。
Olumiant和Rinvoq尚未进行类似于Xeljanz的大型安全性临床试验的研究,因此尚未充分评估其风险。然而,由于这两种药物与Xeljanz具有相同的作用机制,因此FDA认为这些药物可能具有与Xeljanz安全性试验中所见相似的风险。
另外两种Jak抑制剂:Incyte公司的Jakafi(鲁索替尼)和百时美施贵宝的Inrebic(fedratinib)不适用于治疗关节炎和其他炎症,因此不属于Xeljanz、Xeljanz XR、Olumiant和Rinvoq处方信息所需更新的一部分。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






