FDA已批44种 伴随诊断产品数量激增
发布时间:2021-09-13 17:25:21作者:李项来源:医药经济报
预测性生物标志物是实现精准医疗的重要条件。随着药物-伴随诊断(CDx)联合开发模式的引入,在全球最大医药市场,美国FDA批准的伴随诊断产品数量引人注目。获批的伴随诊断检测产品主要涉及血液和肿瘤药物,如果没有准确可靠的伴随诊断检测,这些药物将失去价值。
2011-2020年,FDA批准35种
2014年,FDA发布了关于《体外伴随诊断试剂指导原则》的监管指导文件,将这种类型的检测定义为体外诊断设备(IVD),可提供对安全有效使用相应治疗产品至关重要的信息。伴随诊断的使用,在检测使用说明和相应治疗产品的标签中都有规定。这意味着,在美国使用伴随诊断检测进行测试是强制性的,而且必须在向患者开具特定治疗产品处方之前进行。
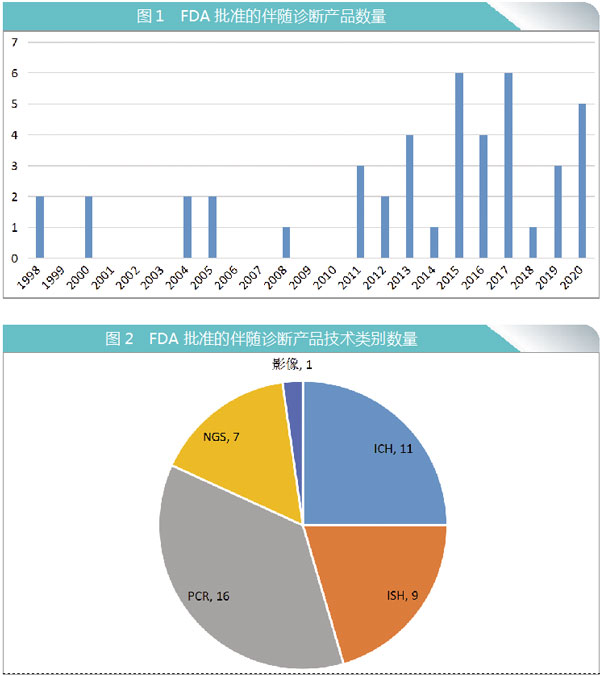
FDA自1998年首次批准伴随诊断产品以来,截至2020年底,获批产品总数达到44种。
2010年(包括2010年)之前,FDA仅批准了9种伴随诊断检测产品,此后的10年间批准了35种。这些伴随诊断检测产品几乎都与血液和肿瘤药物相关,与同一时期FDA批准的靶向抗癌疗法数量增加遥相呼应。
过去20多年来观察到的趋势显示,在抗癌药物开发中,药物-伴随诊断检测产品联合开发模式越来越普遍。
从FDA批准的伴随诊断检测相关的生物标志物、药物和适应症来看,药物-伴随诊断检测产品联合开发模式主要基于“一种药物一种生物标志物”。尽管与伴随诊断产品同时获批的小分子靶向药物占绝对优势,但需要生物标志物检测的单抗药物也在不断增加。
诺华的地拉罗司(Exjade)是一种铁螯合剂,适用于非输血依赖型地中海贫血症(NTDT)患者慢性铁过载的治疗。为筛选Exjade适用人群,FDA授予FerriScan作为肝铁浓度(LIC)测量影像诊断方法的上市销售许可。FDA此前批准FerriScan用于肝铁浓度测量,不过,Exjade临床研究中用它进行治疗患者筛选和治疗管理,因此确立了其作为Exjade安全和有效使用所必需的伴随成像诊断方法的地位。
技术平台快速革新
从不同伴随诊断检测的分析平台来看,免疫组织化学(IHC)和原位杂交(ISH)是主导技术,直到2011年,第一个基于聚合酶链反应(PCR)方法的伴随诊断获得批准,即cobas 4800 BRAF V600突变测试产品(罗氏)。该产品是一种用于黑色素瘤患者BRAF V600E突变的检测,这些患者可能是维罗非尼(Zelboraf)治疗的候选者。目前,PCR技术构成了最大的伴随诊断检测类别:共有16种基于PCR的检测产品获得FDA批准,占FDA批准的所有伴随诊断检测产品的36%。
过去五年中,新一代测序(NGS)已经成为新的伴随诊断平台。FDA批准的第一个基于该技术的检测方法是FoundationFocus伴随诊断BRCA检测(Foundation Medicine公司),这是一种检测卵巢癌患者肿瘤组织中BRCA1和BRCA2改变的检测方法,这些患者可能是接受鲁卡帕里布(Rubraca)治疗的候选者。目前,7种基于NGS不同的伴随诊断检测产品已获FDA批准。
2018年,FDA批准了广谱抗癌药物——拜耳/Loxo Oncology公司的larotrectinib(Vitrakvi),用于治疗携带NTRK基因融合的成年和儿童局部晚期或转移性实体瘤患者,不需考虑癌症的发生区域。直到2020年,FDA才批准FoundationOne伴随诊断产品用作首个伴随诊断方法,以帮助鉴定可能适合使用Vitrakvi治疗的神经营养受体酪氨酸激酶(NTRK)基因融合阳性患者。FoundationOne是FDA批准的针对所有实体瘤的综合基因组分析(CGP)测试产品。
值得一提的是,在美国,大多数伴随诊断检测是高风险设备,归类为Ⅲ类,需要提交上市前申请(PMA)。
期待国内早日实现技术突破
在我国,国家药监局今年4月7日发布《基于同类治疗药物的肿瘤伴随诊断试剂说明书更新与技术审查指导原则》。国家市场监管总局今年7月22日出台《体外诊断试剂注册与备案管理办法》,并于2021年10月1日起施行。伴随诊断市场发展的政策支持日益完善。
当前,我国高端分子诊断设备平台严重依赖进口,随着国内该领域长期的技术积累和创新,期望尽早实现技术突破和国产替代。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






