创新药审评刷新记录 药审国际赛道加速前行
发布时间:2021-08-30 15:51:02作者:本报记者 胡睿 发自北京来源:医药经济报
独家专访CDE主任孔繁圃
近年来,国家鼓励药物创新的政策红利不断加码,一批批临床急需药品纷纷获批入市。《医药经济报》记者从国家药监局获得的数据显示,2021年上半年已有21个1类创新药获批上市,这一数字已经超过2020年全年20个创新药审评通过数量,意味着我国在创新药审评上刷新了记录。
从治疗领域看,这些产品主要涉及突发公共卫生事件应急所需防治药品,肿瘤、罕见病和免疫系统疾病等临床急需药物,其中多个为我国自主研发并拥有自主知识产权的产品。
众所周知,新冠疫情发生后,用于新冠肺炎的防治产品特别审批任务量非常大。截至6月30日,4个新冠疫苗已经附条件批准上市,22个疫苗和19个治疗用生物制品(包括12个中和抗体)通过特别审批程序获批开展临床试验;“三方”相关中药品种(清肺排毒颗粒、化湿败毒颗粒、宣肺败毒颗粒)批准上市。
在新冠肺炎防治产品应急审评的巨大压力下,创新药获批数量刷新记录是如何实现的?国家药监局药审中心主任孔繁圃告诉《医药经济报》记者,这和近年来药品审评审批体制改革一系列“组合拳”密不可分。
他指出,为适应医药产业创新需要,2020年7月药审中心就开通了多条药品加快上市注册程序通道,近年来药审中心不断制修订指导原则,目前总数量已达到300余个。这一系列做法就是要把有限的审评资源用在具有明显临床价值的创新药和急需药上。经过近几年的实践和优化,这些改革措施已经开始逐步显效。
按时限完成超90%
谈及中国药品的审评审批之路,我们都不曾忘记积压达2.2万件的高峰时段。孔繁圃回忆,2018年底刚到药审中心任职时,药品审评审批制度改革相关政策还没有完全落地,《药品注册管理办法》等也还没有适应药品审评审批制度改革等要求,国家药监局领导也有批示需要快速解决改革中落地难的问题。
为了推进药品审评体系和审评能力现代化,药审中心开始构建药品审评流程导向科学管理体系建设,把整个审评工作按照流程分为8个环节,包括任务受理、任务分配、专业审评、综合审评、沟通交流、专家咨询、书面发补、核查检验。每个环节都设立了课题小组,根据研究的问题,提出改进措施,并逐步运用到《药品注册管理办法》配套文件的修订中。
不完全统计数据显示,在《药品注册管理办法》的配套文件修订中,由药审中心牵头完成的涉及30个。
“从那时起,我们就通过修订配套文件、起草指导原则等手段来提高审评质量和审评效率。”孔繁圃谈到,印象最深的就是开通、优化了4条药品加快上市注册程序通道:突破性治疗、附条件批准、优先审评审批、特别审批。为了把有限的审评资源用在具有明显临床价值的创新药和急需药上,优先审评由原来的18项内容按照临床急需缩减到了5个。特别审批在去年新冠疫情中已经有所突破,通过早期介入、持续跟踪、滚动提交、研审联动确保了新冠疫苗和新冠药物的快速研发上市。
孔繁圃表示,在总结抗疫产品特别审批经验的基础上,未来这些方法也会逐步运用到创新药物的审评上。
数据显示,2021年上半年,受理注册申请任务5802件(以受理号计),受理量同比增长15.14%;审结量4819件,同比增长19.55%,审结任务整体按时限完成率为98.22%。在药品注册申请任务受理量同比增长、申报品种技术含量高的情况下,药审中心创新药相关审结任务整体按时限完成率超过90%。
近年来,药审中心也不忘对标国际最新做法。美国FDA的处方药付费法案(PDUFA)允许制药企业支付申请费,帮助审评机构增加人力和物力,但审评任务按时限完成率要达到90%。孔繁圃坦言:“这一完成率去年我们还做不到,但今年上半年,无论是创新药还是仿制药,整体审评完成率都已经超过了这个水平。”
加速完善标准建设
为引导企业在研发上少走弯路,有效缩短新药研发进程,近年来药审中心也作出了大胆尝试。
2020年,药审中心起草了119个技术指导原则,正式发布了71个,在此基础上,2021年上半年又发布了37个。2021年全年计划制定102个,覆盖新冠肺炎防治药品、中药、化学药、生物制品、儿童用药和个药等多个领域,目前均全部启动,其中正在征求意见12个,已完成公开征求意见24个,已报送国家局审查12个,经国家局审查同意即将发布2个。 孔繁圃解释说:“在2020年之前,我们只有204个药物研发技术指导原则,这一两年间我们就增加了100多个,加起来已经超过300个,明年这一数字还会有大幅增长。目前,从已发布指导原则数量来看,欧盟有400多个,美国比欧盟多一些。”这也显示了我国药品审评制度正在国际赛道上加速前进。
此外,药审中心还不断探索发布了《用于产生真实世界证据的真实世界数据指导原则(试行)》,推动建设能切实指导实践的真实世界研究相关指导原则体系。
采访中,记者了解到,真实世界研究对儿童用药信息增补起到关键作用。由于儿童临床研究实施困难,如何利用已有研究数据支持儿童用药研发和临床合理使用,是目前全球监管机构面临的共同难题。
孔繁圃表示,下一步药审中心将针对全球尚未批准儿童应用,但境内外指南已明确推荐儿童应用的药品,进行回顾性研究或探索真实世界数据支持儿童用药研发的模式,通过遴选品种开展试点,提供儿童应用证据,支持说明书适应症扩展,解决临床经验性给药的问题,消除广大家庭的儿童用药安全隐患。
另外,在鼓励中药创新方面。孔繁圃表示,中药审评既要坚持现代化评价手段,也要重视中药传承的重要性。结合中药“三方”在抗疫中的临床实践,药审中心首次按照3.2类“其他来源于古代经典名方的中药复方制剂”,加快完成抗疫成果转化。下一步,药审中心会参考“三方”相关品种的审评经验,落实组建古代经典名方中药复方制剂专家审评委员会的工作要求,逐步探索符合中医药特点的审评工作程序和技术要求。
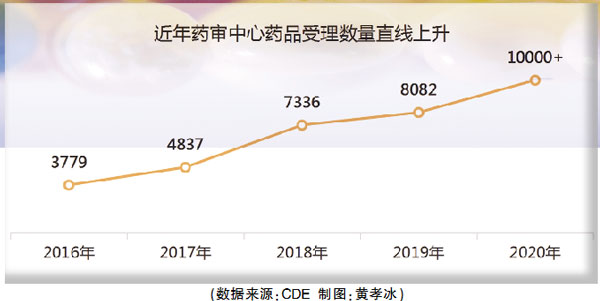
受理数量直线上升
从近年来药审中心发布的年度审评报告不难看出,药品受理数量呈现“直线式”上涨:2016年为3779件,2017年4837件,2018年上涨到7336件,2019年8082件,2020年已经超过1万件。不完全统计数据显示,疫情期间药审中心受理量增加了26%。
“长期这样下去,人力是无法实现的。”孔繁圃坦言,“从近几年的受理数量看,我们的补充申请比美国FDA还要多,FDA的CDER和CBER现在共有7000多人,而药审中心只有700多人,人力严重不足。我们在改革实施中总结出的方式方法,苦于人力不足都很难施行。例如提前介入,2016年我们的沟通申请还只有300多件,去年沟通交流的申请已经达到3000多件,虽然是10倍的增长,但仍然无法满足企业沟通交流的需求。”
近几年,创新药红利已经逐步释放,申报受理数量也在大幅上涨,药审中心作为引领产业研发的“舵手”,如何引导企业理性开发?
孔繁圃表示,不可否认,在鼓励企业创新的同时,个别领域也出现了过热的情况,被研发界称为“伪创新”。药物上市的根本目的是解决患者需求,药物研发应以患者需求为核心,以临床价值为导向。药审中心在指导原则的制修订上也会注重这方面的引导,将有限的研发资源、审评资源用在解决临床急需上。
同时,对于业内较为关心的药品长三角分中心和药品大湾区分中心职能问题,孔繁圃回应,这两个分中心设立在医疗产业活跃地带,就好像药审中心的“两只手”,会和药审中心融合在一起。目前,两个分中心还在招聘人员,初期药审中心会指导他们加强与当地研发企业的沟通交流,等到具备审评能力后,再增加业务职能。
近年来,在国家政策和法律法规的支撑下,我国已经建成相对完善的医药创新生态系统,部分本土企业在研发上的投入已经从10%提高到20%,中国创新对全世界的贡献率也在不断提高。随着高水平的药品审评机构和高质量的医药创新相互支撑、相互促进,孔繁圃表示,未来会有更多创新好药为公众服务,临床上的很多治疗难题也会慢慢得到解决。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






