单臂试验“捷径”很火想入? 先答好五道题
发布时间:2021-08-25 17:01:20作者:胡善联 复旦大学公共卫生学院教授来源:医药经济报
尽管随机对照临床试验(RCT)方法是评价药物疗效的金标准,但并不总是可行。近年来,在药物审评审批中,越来越多申报材料是基于单臂试验的数据。在我国医保药品目录申报中,单臂临床试验的身影也越来越多。
2019-2020年参加国家价格谈判和进入医保药品目录的产品中,有12个产品进行了单臂研究,分别是泽布替尼、阿法替尼、阿美替尼、克唑替尼、可洛派韦、塞瑞替尼、吡咯替尼、卡瑞利珠单抗、特瑞普利单抗、替雷利珠单抗、来迪派韦+索磷布韦和注射用重组人凝血因子Ⅷ(turoctocog Alfa)。
2021年国家医保药品目录调整,在通过初步形式审查的申报药品中,又有22种药物涉及单臂临床研究,包括奥布替尼、赛沃替尼、普拉替尼、恩沙替尼、吡咯替尼、泽布替尼、伏美替尼、卡瑞利珠单抗、特瑞普利单抗、替雷利珠单抗、信迪利单抗、纳武利尤单抗、帕博利珠单抗、贝林妥欧单抗、维迪西妥单抗、索磷布韦+维帕他韦、来迪派韦+索磷布韦、达诺瑞维钠片、拉维达韦、氟唑帕利、帕米帕利、西达本胺。有些药品由于新适应症而在2021年重复申报。
如何评估这些药品的单臂临床试验,是值得研究和思考的。
RCT对比单臂试验:二者关系?
1.RCT对比单臂试验:二者关系?
传统药品申报进行医保谈判时,大部分提供的临床疗效证据都是根据临床随机对照双盲试验(RCT)的结果,有时也可能在国际多中心数据中分析亚洲或中国患者人群的亚组结果。开展临床试验的目的是测定干预措施(药物或疗法)与参照物对比的疗效、增量的效果或安全性。测试前先设定假设(Ho),看是否比参照药品具有显效、或非劣效的比较结果。采用随机对照试验的目的是避免可能发生的病例选择偏倚。在ICH E10中提到,临床试验应采用外部对照的设计,使结果或疾病的过程具有高度的可比性。
非RCT试验包括单臂试验(single-arm trial,简称SAT)、多臂非对照研究(multi-arm-uncontrolled studies)、转换研究(switchover studies)、网状荟萃分析和真实世界研究(real-world studies)等。
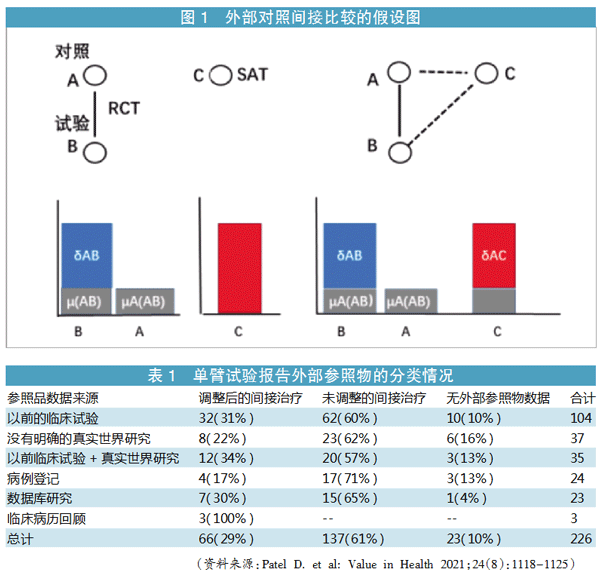
单臂试验可用历史对照或真实世界研究作为外部对照进行间接比较。图1提示RCT与SAT之间的关系。其假设是:A(对照药品)与B(试验药品)的RCT试验的相对治疗效果,也能用于A与C(单臂试验药物)的人群中,即在AB与AC人群中无差异。A可以成为C的外部对照。
2. 什么情况下采用单臂试验?
单臂试验作为药品监督管理审批和卫生技术评估(HTA)的资料日益增多。医保部门往往要求药企提供外部参照物(external comparators,ECs)的补充材料来支持药品的评审和评价,并已成为一种趋势。比如,欧洲EMA机构44%的肿瘤药,以及美国FDA 50%的加速审批药物,都是基于单臂试验的结果。
采纳单臂试验结果的主要原因有:①对罕见病或超罕见病的孤儿药评价,采用RCT方法不可行,而且有悖于伦理问题;②一些具有突破性的治疗方法为加速审批、快速招募患者,不可能开展RCT研究;③针对高度未满足的医疗需求;④患者人数极少,疾病自然史很清楚,研究药物与已有的标准疗法(SOC)相比具有很明显的效果;⑤可采用历史性数据或真实世界数据来对照比较分析。
3. 单臂试验的效益和风险分别是什么?
不可否认,单臂试验既有一定的效益,也有一定的风险。
带来的效益是,可使创新药物更快获得批准,在药品立法上可接受,又可降低临床试验的成本,包括减少患者样本量和后勤服务的成本。
但也存在很大的风险:一是临床试验中的混杂因素难以控制;二是结果的可预见性难以确定 ;三是卫生技术评估(HTA)对单臂试验的可接受程度还存在质疑。
4. 如何提高单臂试验的可接受性?
美国FDA和欧盟EMA在审批药物单臂试验时,是基于历史的对照(historical cohorts)。1991年1月至2014年5月FDA的774件审批申请中,有403件被接受审批,占52.1%,非对照试验审批的适应症有60个(14.8%),其中34件为血液系统的恶性肿瘤。同期,欧盟EMA也有795件申请,415个(52.2%)得到了批准,其中44个(10.6%)是没有对照试验的。可见,美国与欧盟审批药物单臂试验的情况相似。
另外,Patel等报道利用IQVIA HTA Accelerator dataset数据库资料回顾433篇以单臂试验为基础的卫生技术评估报告,虽然只占到2011-2019年九年间提交报告总量的5%,但已呈现出逐年增加的趋势。其中283篇(65.4%)为罕见病和肿瘤药物,其次为免疫和血液类疾病、内分泌和代谢类疾病、感染性疾病,分别占到10%、9%和8%。FDA和EMA对单臂试验均可获得审批或有条件审批的结论。
IQVIA文献数据库平台(www.iqvia.com/landing /hta-accelerator)于2011年建立,包含40多个国家、100多个HTA组织发表的文献报告。报告药品单臂试验的国家有21个,以加拿大、法国、英国、德国和澳大利亚为主。
那么,单臂试验的结果是否可被药监和医保部门接受呢?众所周知,混杂因素会影响到临床疗效结果的准确性,未来迫切需要建立一个单臂试验的临床指南来引导。
支持单臂试验往往需要进一步提交用历史性的队列或真实世界数据作为外部对照(EC)的补充材料。
补充材料的支持证据或条件包括:①如果有个体资料,可通过倾向性得分匹配(propensity score matching)或贝叶氏(Bayesian)统计方法来控制偏倚,减少混杂因素;②外部对照与创新药物指示研究(index study)比较的人群应该是相对同质的;③患者的管理程序是相对标准化的;④初步终点的选择是客观的;⑤新疗法的治疗效果要比历史对照更为明显;⑥临床试验的结果可以外推和转移;⑦具有风险的可逆转性。
5.外部对照方法、参照品如何选择?
选择外部对照的方法,不仅与数据来源有关,而且与选择的方法有关。
在间接治疗方法比较(indirect treatment comparison,ITC)时,参照品数据的类型可以归纳为两类:一类是不经过统计学校正的方法(naive)比较,定义为有或没有统计检验的并行比较;另一种是经过调整(adjusted)的方法,对配对的参比人口基线特征进行统计学校正,即匹配调整后的间接比较(matching-adjusted indirect comparisons, MAIC)或模拟治疗比较(simulated treatment comparisons, STC)。后者可以通过检索原始文献了解所使用的方法。
Patel(2021年)总结了226份单臂试验报告的外部参照物分类结果(见表1)。其中,未经调整的间接治疗占到61%,经过统计学调整的占29%。从参照品的数据来源看,根据以前的临床试验者占大多数(46%),其次是参照真实世界的研究结果。
单臂试验为基础的材料提供情况是复杂的。433份HTA提交的单臂试验审批材料中,48%得到了阳性推荐,其中33%为有条件审批。有外部对照的材料审批的接受率为52%,而没有外部对照的材料接受率只有43%。可见,在审批单臂试验时,药品企业提供外部对照间接比较材料和运用正确的分析方法是重要的。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






