欧盟IVDR实施进入倒计时 亚太市场如何应对
发布时间:2021-08-25 16:50:02作者:张黎来源:医药经济报
由于受新冠疫情影响,欧盟委员会2017年5月颁布的医疗器械法规(MDR)被延期至2021年5月,同期颁布的体外诊断医疗器械法规(IVDR)有5年过渡期,生效期至2022年5月。
目前,距IVDR生效期还有不到一年的时间,然而欧盟及其成员国保障IVDR实施的相关政策框架尚未全面落地。此外,公告机构的数量和资源紧缺也造成了产品审查的大量积压和延时。欧盟委员会因此收到了许多来自多方包括政府和业界的不同意见和建议,其中包括建议欧盟委员会启动立法程序推迟IVDR生效期。截至发稿时,欧盟委员会尚未发布最终决定。
按照目前的时间表,IVDR将于2022年5月26日起正式取代现行的《欧盟体外诊断医疗器械指令》(98/79/EC)(IVDD)。欧盟委员会强调,“有些产品若已获得现行指令(IVDD)下颁发的证书,可以于2024年5月27日前继续投放欧盟市场,并能在欧盟市场上供应至2025年5月27日。”
那么,欧盟IVDR新规对于包括中国在内的亚太市场会有哪些影响?
变化及影响
接受公告机构审查产品从20%到85%
对IVD产品而言,最大的变化是产品风险分类和公告机构的角色。IVDR的分类规则将每个器械产品都归入四种风险类别之一,从风险最低的A类到风险最高的D类(IVDR第47条)。在新法规框架下,大约85%的IVD产品需要接受公告机构审查,而在现行指令(IVDD)下这一比例仅为20%。
绝大多数产品仅为产品信息的非重要变更
欧盟新规会给产品带来什么影响?根据欧洲医疗技术行业协会(MedTech Europe) 的一份报告,IVDR引发的大多数变更仅为产品信息变更,对产品本身的风险/效益特征、质量、性能和使用都没有影响,因此对患者安全可能产生的影响也很有限。
涉信息变更产品数量巨大
与此同时,需要重视的是,由欧盟新规引发的产品信息变更(比如新标签、新公告机构编号等)涉及产品数量巨大。
风险和冲击
监管差异巨大
面对受影响的产品规模之大,以及大部分非重要变更对患者安全可能造成的极低风险,监管机构该如何应对?现行的变更监管机制是否符合基于风险考量的做法?在亚太市场中有哪些良好实践可供其他市场参考,又有哪些繁琐实践值得深思和警示?
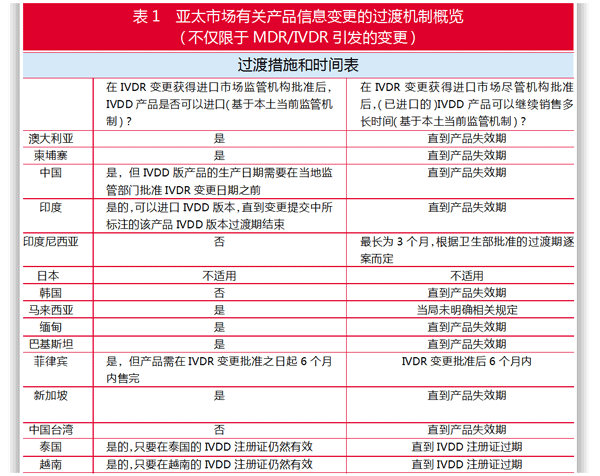
按照亚洲医疗器械法规协调会(AHWP)的定义,我们将不影响器械安全和/或性能的变更统称为“非重大变更”。根据亚太医疗技术协会(APACMed)会员对亚太市场现行变更机制的研究分析可以发现,面对由IVDR引发的同类变更,不同市场的监管要求、路径和时限相差很大。从无需注册或豁免注册,到变更备案、变更注册,甚至到重新注册,注册时限也从0个月到12~18个月不等。这种巨大监管差异的后果是,某些市场的监管机构需要耗费大量监管资源,用于受理、审查和/或批准那些对患者潜在风险极小的非重要变更,甚至会因为监管资源受到挤兑而影响到新产品和产品重大变更的审查和批准工作。
此外,笔者还发现,亚太地区的某些市场给制造商产品信息变更的过渡期很短,而且缺乏灵活性(如表1所示)。面对欧盟新规带来的大量产品信息变更,这些市场有可能面临重要医疗产品供应中断的风险。
或面临“双重过渡”
此外,在欧盟MDR/IVDR的过渡期内,亚太某些市场也正处于本土医疗器械和/或体外诊断医疗器械法规体系的改革期(如中国大陆、韩国、巴基斯坦、菲律宾、中国台湾、泰国和越南等)。因此,这些市场上的制造商和进口商可能面临“双重过渡”监管措施和时间表,政府和业界也可能面临资源紧张的挑战。
应对与启示
基于风险的变更监管机制
在新冠疫情造成多国监管资源紧缺的背景下,越来越多的监管机构开始积极探索由世界卫生组织倡导的“监管依赖”机制。在亚太地区,早在疫情前就已实施“监管依赖”的代表是澳大利亚和新加坡。鉴于欧盟是澳大利亚和新加坡医疗器械监管机制中的参考国之一,两国监管机构与行业协会就如何在欧洲新规过渡期保证当地医疗产品供应以及应对措施开展了紧密对话。
1.澳大利亚:澳大利亚治疗产品局(TGA)对产品信息变更一直采取基于风险管理的方法,即只要产品信息变更后仍然符合本国的医疗器械安全和性能的基本原则要求,则无需采取任何行动。当然,制造商需要在其质量管理体系中有变更控制相关记录备查。只有当产品的预期用途、预期用户或者产品性能发生改变(即实质性重大变更)时,才可能需要提交有关变更申请。
2.新加坡:新加坡卫生科学局(HSA)对医疗器械监管也采用基于风险管理的方法,特定的微小变更无需提交申请。新加坡卫生局通过当地行业协会多次征求行业建议,2020年10月发布了《针对欧盟新规MDR/IVDR所引发注册医疗器械产品变更的申请指南》,进一步简化了因欧盟新规MDR/IVDR而产生的产品信息变更的审查和评估。该指南指出,标签和说明书变更只要不改变产品的安全和性能,就可以免于提交任何变更申请。此外,增加“不含某毒害物质”的说明、对说明书内容的解释或者增加不良反应/副作用信息、在相同非临床和临床数据基础上增加产品性能数据或对数据予以解释,都从原本需要审批改为只需要变更备案而无需审批。
此外,国际医疗器械监管机构论坛(IMDRF)成员国中有五个国家位于亚太地区:澳大利亚、新加坡、中国、日本和韩国。按照日本和韩国的现行监管机制,“非重大变更”无需提交任何申请。根据中国的现行法规,某些“非重大变更”仍需酌情申请登记事项变更或者许可事项变更。据笔者了解,739号令相关配套文件,如《体外诊断试剂注册管理办法(征求意见稿)》和《体外诊断试剂许可事项变更技术审查指导原则(征求意见稿)》尚未正式发布,而这些文件的出台可能对中国现行的变更注册机制产生积极影响。
确保适当的过渡措施
当前,欧盟体外诊断新规进入倒计时,而欧洲方面保障新法落地的关键框架缺失及公告审查机构的资源瓶颈,预计将对高风险产品、伴随诊断产品、新冠检测产品和即时检测/自检产品的全球供应带来极大挑战。
因此,笔者建议亚太各市场做好行业(尤其是出口欧洲的企业)培训工作,全面了解欧盟新规的相关要求及最新出台的相关指南文件。有关监管机构应结合当地的变更监管措施以及欧盟新规的特殊情况,参考借鉴其他市场的最佳实践经验,尽可能简化IVDR相关变更的监管工作,确保适当的过渡措施。这不仅能减少主管部门审核和评估大量变更申请带来的工作负担、提高监管效能,也能避免在全球大流行期间出现重要医疗产品供应中断的风险。
笔者也希望监管机构与产业界在IVDR以及其他本土新规实施和过渡期间开展更加务实的交流,共同探讨适宜的解决方案。
(本文在撰写过程中参考了亚太医疗技术协会(APACMed)关于欧盟IVDR法案对亚太地区影响的有关研究)
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






