三胎放开、政策鼓励 儿童药立项机会在哪?
发布时间:2021-08-06 14:44:53作者:本报特约撰稿 边界来源:医药经济报
国家新规一直在鼓励儿童药上市,鼓励三胎的政策后更是鼓励儿童药研发,儿童药申报可走临床急需通道。
按照2021年7月7日国家药监局发布的《药品上市许可优先审评审批工作程序(试行)》,“符合儿童生理特征的儿童用药品新品种、新剂型、新规格”均可申请适用优先审评审批程序。药审中心对儿童用药开辟独立审评通道,设立“儿童用药”特殊标识,并在沟通、受理、审评等环节主动服务,提高品种处理效率,确保优质儿童用药尽快上市。
大环境预示着儿童药的春天来了。那么,儿童药研发会遇到哪些问题?更好的立项方向在哪儿?
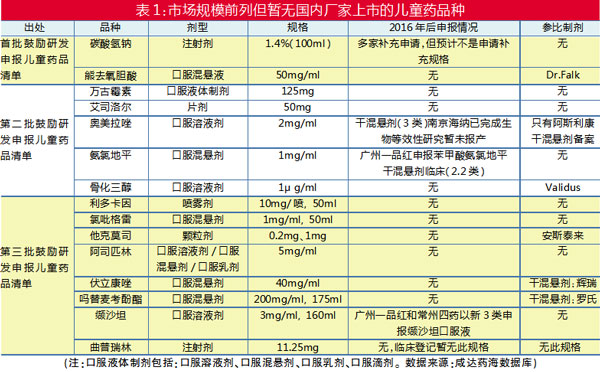
A 上市/申报情况
不做临床也能上市,已有案例
2021年3月底,特丰制药的2.2类改良型新药水合氯醛/糖浆组合包装获批上市。该药是首批鼓励研发申报儿童药品清单中的品种,被批准用于儿童检查和操作前的镇静与催眠。多年来,我国仅有该品种的医疗机构院内制剂,缺少上市药品。此次获批上市的产品是在境外上市的水合氯醛口服液及我国医疗机构院内制剂的基础上进行改良,实现了儿童剂量的精准计量,提高了口感适宜性。该药在CDE药品临床试验登记与信息公示中暂无临床登记。
2019年特丰制药还上市了独家产品水合氯醛灌肠剂,按仿制药3类申报。2020年登记的临床研究为“水合氯醛灌肠剂在中国儿童惊厥/检查操作前镇静催眠患者中的群体药代动力学研究”。
水合氯醛/糖浆组合包装和水合氯醛灌肠剂是近年来为数不多的由我国企业主导的儿童药。
同样以新3类获批的还有2019年的吉林四环澳康的咪达唑仑口颊粘膜溶液5mg/ml(1ml)。该药也没有在CDE药品临床试验登记与信息公示中查询到临床登记信息。
15个清单大品种无申报,8个无参比制剂
从2016年5月起至今,共发布了三批鼓励研发申报儿童药品清单,合计106个药品。笔者统计,通用名销售额排名前列但尚未有国内厂家申报的产品共15个,其中8个产品没有参比制剂(见表1)。
其中,碳酸氢钠注射液的批文有141个,生产厂家超过20家,但没有1.4%(100ml)规格上市,理论上已上市厂家只需补充规格就可申报此规格上市。而从参比制剂数据库可知,暂无厂家备案碳酸氢钠注射液。
没有参比制剂备案通常意味着没有厂家申报,或者已申报但参比制剂尚未通过或者不予通过。但是,也有厂家在未有参比制剂备案通过的情况下申报,例如广州一品红和常州四药以新3类申报缬沙坦口服液。
干混悬剂暂无申报,需生物等效性研究
有参比制剂但无厂家申报的剂型主要是干混悬剂,熊去氧胆酸、伏立康唑和吗替麦考酚酯都有参比制剂,但暂无厂家申报,预计是因为这类产品需要做生物等效性研究。这三个产品中仅伏立康唑有企业启动了生物等效性研究:珠海润都制药和浙江普利药业已经分别启动了伏立康唑干混悬剂的生物等效性研究。
同样可能需要启动生物等效性研究的还有他克莫司颗粒。2020年8月,安斯泰来的他克莫司颗粒正式在中国获批上市,用于预防儿童肝脏或肾脏移植术后的移植物排斥反应,治疗儿童肝脏或肾脏移植术后应用其他免疫抑制药物无法控制的移植物排斥反应。他克莫司颗非常有可能仍在专利期。
无需启动生物等效性的骨化三醇口服溶液剂,同样暂无厂家申报,但已有参比制剂备案。鉴于该剂型暂无国内上市,预计已有厂家在研。
更多进口孤儿药获批上市
目前,三批鼓励研发申报儿童药品清单中,上市获批了较多进口孤儿药:预防儿童肝脏或肾脏移植术后移植物排斥反应的他克莫司颗粒、治疗肺动脉高压的波生坦片、治疗阵发性睡眠性血红蛋白尿症(PNH)和非典型溶血性尿毒症综合征(aHUS)的依库珠单抗注射液、用于1型戈谢病长期酶替代治疗的注射用维拉苷酶α,以及治疗婴儿痉挛(IS)的氨己烯酸散。
B 研发难点
与政策鼓励的力度相比,国内企业儿童药品的研发数量仍显不足。有些药品已经有通用名上市基础,企业申报上市后不需做过多的市场推广,有的甚至可以替换已有产品的市场。为什么企业对儿童药的研发热情不高?
①辅料缺少儿童安全性数据
儿童用药的研发首先要考虑安全性。但是,目前大部分辅料都没有幼龄动物的安全性实验数据。
②许多儿童药缺少参比制剂
仿制药面临的主要难题之一是没有参比制剂。不少在日本、美国上市的儿童药是OTC药品,原研药早已退市。如果没有“无参比制剂目录”,预计企业是无法仿制的。而且,OTC快速通道暂未出台正式实施通知。
③如不能豁免临床,研发难度太大
如果没有参比制剂,企业可以走改良制剂的道路,但这需要临床研究。然而,儿童药的临床研究非常困难,儿童受试者招募、安全和利益保护难度远超成人。
不少企业研发儿童药都希望能够豁免临床研究,而对需要临床研究的儿童药项目望而却步。
④若纳入集采,儿童剂型如何竞价?
国内最多在研的儿童药清单药品是左乙拉西坦注射用浓溶液。该品种在首批鼓励研发申报儿童药品清单中,但已经是被集采(第三批)的产品,国内企业已有11家仿制药上市。
儿童用药进入集采的还有孟鲁司特等药物。
由此可见,只要上市竞争家数足够多,儿童药的仿制药依然逃不过被集采的命运。从投资回报来看,同样是做仿制药,为什么不做市场规模更大的产品,而去做儿童药呢?
鼓励的药品主要是口服溶液/口服混悬剂/颗粒剂,目前医保部门正在研究集采药品同一用药路径的价格联动事宜。如果口服溶液和普通固体口服制剂价格联动,不独立分组,根据差比价的规定,口服溶液和普通固体口服制剂的价格差不会太大。
除非儿童新适应症的产品可以单独分组竞价,才可能有较大的价格差。但目前的集采并未对儿童药独特剂型提出更高价格的规定。
C 未来突破
真实世界研究
目前来看,真实世界数据研究有望减免头对头的临床研究,可扭转招募困难的困境。
真实世界研究相关政策2020年开始正式落地,配套政策也在陆续发布中。
企业需要与一直有数据积累的儿科临床研究机构合作,共同立题。预计真实世界研究需要3年。
挖掘院内制剂
已经获批上市的水合氯醛/糖浆组合包装正是一种在不少医疗机构儿科临床使用多年、疗效优秀、广受好评的院内制剂。但是,由于注册成本较高,一直难以实现转化。
药审中心发布真实世界证据支持儿童药物研发的技术文件后,医院可通过收集既往临床应用数据,凭借真实世界数据研究成果,将医疗机构院内制剂推向市场。
企业可以考虑与儿童医疗机构合作产学研项目,转化具备真实世界数据研究的产品。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






