AD新药获批 研发黑洞现曙光?
发布时间:2021-06-16 12:15:51作者:李勇来源:医药经济报
今年最受关注的药品审评终于有了结果。美国FDA近日加速批准了渤健的aducanumab(商品名为Aduhelm)用于治疗阿尔茨海默病(AD),这是近20年来FDA批准用于AD的首种新型疗法,也是首款针对AD潜在病理生理学(大脑中β淀粉样蛋白斑块)的治疗药物。
FDA打破政策僵局
长期以来,AD新药研发领域一直未能取得显著进展,无数失败的开发项目让巨额投入的企业一筹莫展。尽管FDA加速批准aducanumab也存在争议,但其设定的新监管标准,将为打破目前的僵局,向前推进AD新药开发起到巨大的促进作用。
FDA此次对aducanumab的审批是在加速批准途径下暂时开绿灯,其在批准公告中表示,加速批准途径针对一种治疗严重或危及生命的疾病的药物,当该药被证明对合理可能的替代终点产生影响时,其可能比现有治疗提供有意义的治疗益处,但该药的临床益处仍存在一些不确定性。
Aducanumab获批是根据从大脑中清除β淀粉样蛋白的替代结果,而非以患者为中心的临床获益结果。FDA指出,aducanumab加速批准途径的条件已经满足,渤健需进行进一步的研究以确定该药的临床效益。
从FDA的这一决定来看,监管机构可以为AD新药树立新的先例。FDA在这方面的做法将促使药企在斑块减少与临床益处之间的联系尚未确定时,更多地关注生物标志物数据,从而为其他具有类似机制的药物打开大门。
罗氏、礼来燃起希望?
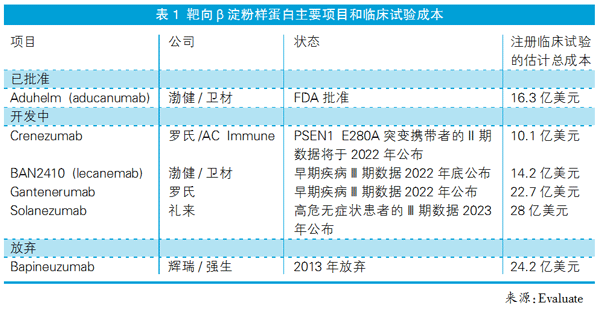
近年来,不少药企都在AD新药研发领域折戟。从全球主要大型制药公司抗β-淀粉样蛋白单抗项目临床试验的预估成本来看,进入临床中晚期的项目投入都在十亿美元以上(见表1)。而aducanumab的获批也让该领域其他开发者看到了希望。
正在开发抗β-淀粉样蛋白单克隆抗体的公司无疑都是潜在的间接受益者,例如罗氏、礼来等,都有相关单抗项目正在进行临床试验。
礼来的solanezumab虽然已停止对治疗AD和早期AD的临床研究,但该公司并未停止在AD药物研发领域的步伐。此外,礼来还有独立开发的AD候选单抗药物donanemab。该公司在今年3月公布的Ⅱ期临床试验数据显示,donanemab可以帮助清除AD患者的脑内β淀粉样蛋白斑块,但临床意义和安全问题仍不清楚。
罗氏的gantenerumab虽然在2014年未能通过Ⅲ期临床试验,但2017年该公司重新启动了对该药的研究工作。目前gantenerumab正在开展两项Ⅲ期试验,预计将于2022年获得数据。与此同时,罗氏还在与AC Immune合作开发另一款抗β-淀粉样蛋白单克隆抗体crenezumab,目前已进入Ⅱ期临床研究。
对于渤健,除了aducanumab之外,其还与合作伙伴卫材正在开发另一种AD新药BAN2401,目前处于Ⅲ期临床试验阶段。
而随着aducanumab获批,现实中仍然存在其他关键问题待解:例如,如何诊断患者,保险公司如何承保aducanumab,如何筛查患者可能出现的副作用,以及如何将aducanumab引入临床实践以解决整个医疗保健系统的系统性差异等。此外,验证性试验设计的问题也成为了关注焦点。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






