“百抗”冰火两重天 “双抗”成也平台、败也平台
发布时间:2021-06-11 17:51:01作者:本报特约撰稿 边界来源:医药经济报
“百抗”,谁在蓬勃?
许多重磅药,数个“超级重磅炸弹”
2021年,美国FDA批准的抗体(含“双抗”)已经超过100种,距1986年全球第一个鼠源性单抗药物Muromonab OKT3获得美国FDA的上市批准仅过了35年。近年来,FDA每年批准的新药中,抗体药物基本上占据了1/5,平均每年有超过10种抗体药物获批。近几年,全球药品销售排名前十的产品中有不少是抗体药物,抗体药物领域里诞生了数个年销售额超过50亿美元的“超级重磅炸弹”药物。只要找对靶点和适应症,抗体药物获批后就能获得高额回报。
依托PD-1,中国有望进入“百抗年代”
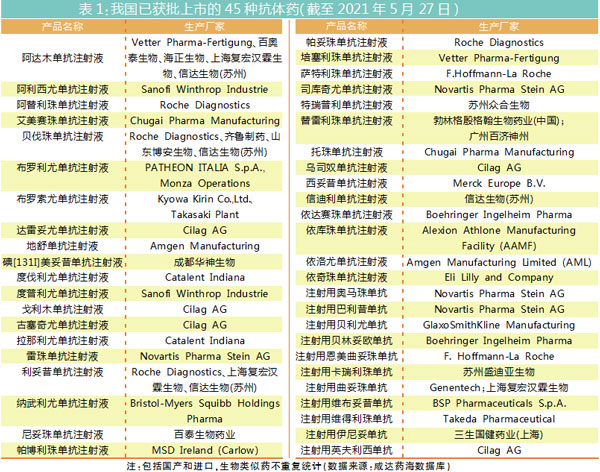
我国首个单抗药物注射用抗人T细胞CD3鼠单抗1999年上市,距今已有22年的历史。截至2021年5月27日,我国已获批上市的抗体药共45种(包括国产和进口,生物类似药不重复统计),以单抗为主。据悉,随着我国PD-1/PD-L1的上市,以及美国已上市的抗体药物在我国上市,2025年我国也有可能进入“百抗年代”。
靶点集中:全球热点VS中国热点
全球目前已经商业化的抗体产品靶点相对集中,其中PD-1/PD-L1是最热的靶点,排名前十的靶点还有CD20、TNF、HER2、CGRP/CGRPR、VEGF/VEGFR、IL-6/IL-6R、IL-23 p19、EGFR、CD19。国内抗体药的热门靶点为PD-1/PD-L1、TNF、VEGF/VEGFR、HER2、IL-17和CD20。
“双抗”,何以失意?
全球仅批准上市4个,已退市1个
相较于单抗的蓬勃发展,“双抗”还处于萌芽阶段。美国上市的抗体药中,“双抗”仅有3个产品。
目前,全球不同临床开发阶段的“双抗”大约有120种,但仅仅上市了4款,其中1款已经在上市国退市。目前已获批上市的4款产品分别为 Removab(catumaxomab)、Blincyto(blinatumomab)、Hemlibra(艾美赛珠单抗注射液emicizumab)和Rybrevant(amivantamab-vmjw)。
其中,Removab于2009年首次在德国上市,靶点为CD3/EpCAM,是全球首个商业化的治疗恶性腹水的“双抗”药。后因销售不佳及副作用等原因,于2017年退市。凌滕医药在国内引进此产品。
Blincyto(靶点CD3/CD19 BiTE)是基于德国Micromet公司开发的BiTE(Bispecific T-cell Engager,双特异性T细胞衔接器)平台研发的“双抗”药,2014年12月获FDA批准在美国上市,适应症为淋巴细胞白血病。2020年12月,Blincyto在国内上市,百济神州拥有中国权益。2020年,Blincyto全球销售额为4.21亿美元。
Roche/Chugai使用ART-Ig技术开发的Hemlibra(靶点FIX/FX bsAb)于2017年11月获FDA批准,成为第二个在美国上市的双特异性抗体,适应症为A型血友病,2020年销售额为22.87亿美元。艾美赛珠单抗注射液2018年已在我国上市,2020年医院终端销售额为1721万元,预计在我国很难创造美国的辉煌。
2021年5月21日,美国FDA加快批准了强生旗下的杨森制药公司研发的EGFR/c-Met“双抗”Rybrevant,是全球第四个上市的“双抗”。用于治疗经FDA批准的测试确认的患有表皮生长因子受体(EGFR)外显子20插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者,这些患者接受铂类化疗期间或之后发生了疾病进展。
Rybrevant依托的平台是总部位于丹麦哥本哈根的Genmab的DuoBody技术平台。DuoBody平台与多家公司合作开发“双抗”产品,并已有产品进入Ⅲ期临床阶段,比如与艾伯维合作的治疗B细胞非霍奇金淋巴瘤的epcoritamab(靶点CD3/CD20),与诺和诺德合作的治疗A型血友病(靶点FIX/FX)的Mim8。
2021年,“双抗”失意年
2021年是不少“双抗”项目失意的年份。
2021年1月15日,德国默克的明星“双抗”bintrafusp alfa(M7824,靶点PD-L1/TGF-β)治疗接受过免疫检查点抑制剂(ICB)后疾病进展微卫星高度不稳定(MSI-H)/错配修复缺陷(dMMR)实体瘤患者的Ⅱ期临床研究以失败告终,因未能显示出抗肿瘤活性。五天后,M7824再次折戟于挑战Keytruda的非小细胞肺癌的Ⅲ期研究,未能达到无进展生存期(PFS)的预设终点。3月16日,德国默克宣布其M7824二线治疗胆管癌Ⅱ期临床未达到主要终点,宣告失败。
2018年6月,M7824在美国临床肿瘤协会年会(ASCO)上公布的临床数据很惊艳。该试验针对没有用过PD-1抑制剂的晚期非小细胞肺癌患者,1200mg剂量M7824治疗组纳入了40个患者,有效率明显高于PD-1,特别是在PD-L1高表达患者中,M7824的有效率高达71.4%,而PD-1的有效率一般只有29%~44%。正是由于这个惊艳的临床数据,目前国内已有不少药企跟进了PD-L1/TGF-β“双抗”组合的布局,包括君实生物、恒瑞医药、创胜集团、普米斯生物、友芝友生物、南京维立志博生物、和铂医药、乐普生物等。
失意不只发生于M7824这一个项目。
2021年3月,安进终止了3款“双抗”产品临床试验,分别是AMG701(BCMA/CD3)、AMG673(CD33/CD3)和AMG596(EGFR/CD3)。3款“双抗”都是基于德国Micromet公司开发的BiTE(Bispecific T-cell Engager,双特异性T细胞衔接器)平台。2012年,Micromet被安进收购,安进获得了BiTE技术,属于无Fc区域的非IgG样“双抗”平台技术。BiTE原有技术有半衰期短的问题,安进进一步设计了half-lifeextended(HLE)BiTE分子。2021年3月失败的产品中,AMG701和AMG673就是half-lifeextended(HLE)BiTE分子。这为BiTE技术其余的半衰期延长的“双抗”产品的未来蒙上阴影。
2021年5月,辉瑞宣布AMG701同靶点的BCMA/CD3“双抗”elranatamab 的MagnetisMM-3的Ⅱ期临床试验因发生3例外周神经损伤而暂停招募患者。此前Ⅰ期临床中elranatamab的应答率高达83%,Ⅱ期试验原计划是作为加速审批上市的主要根据。BCMA是CAR-T已上市的靶点,CD3是目前已经上市的3个“双抗”中的2个的靶点之一,也是目前国内外“双抗”大部分在研企业的必选靶点,BCMA/CD3会否“死亡之组”还有待杨森/Genmab、岸迈生物等国内外企业的临床证据验证。
★★★ 小结 ★★★
单抗的开发主要看靶点,“双抗”的开发主要看平台。因此“双抗”如果有一个产品能够上市,肯定会吸引大企业的并购或者更多的大企业愿意一起合作开发,前者如安进的BiTE平台,后者如Genmab的DuoBody平台。
但是,平台技术同样存在一个问题就是:同一平台开发的产品具备共性的缺陷,而如果该缺陷会影响上市,那么基本上同类的产品都有风险。
究竟哪些平台技术更具备可持续的未来?目前各平台的上市产品有限,仍待时间一一验证。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






