FDA拒批药物数量保持稳定
发布时间:2021-05-26 19:14:53作者:综合编译/王迪来源:医药经济报
美国业界越来越担心FDA会变得越来越严格,今年以来已经出现过好几个该机构采取强硬立场的例子。但Evaluate Vantage对FDA发出的完整回应函(CRL)所做的一项分析发现,去年这一数据并未明显增加。
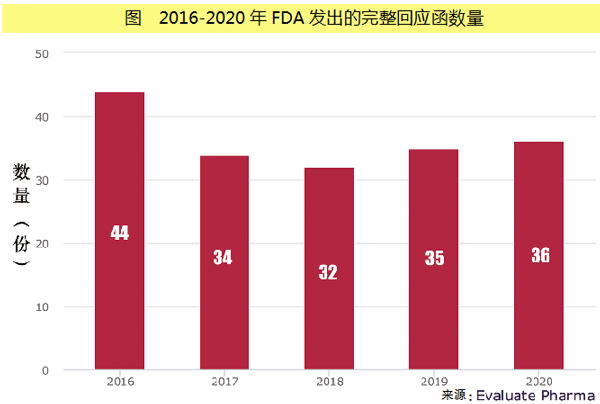
CRL数量无明显起伏
不过,这种情况近来可能已经发生了变化,一些市场分析人士向投资者提醒称,监管环境正变得越来越严厉。但是,即使是在今年,FDA已经发出的CRL数量也没有引起人们的关注。因为这一数据仅为5份,其中包括4月初FDA对Acadia公司的Nuplazid发出的一份CRL。
需要注意的是,FDA并没有发布CRL的数量,Evaluate Vantage的数据来源主要是公开可用的新闻稿、美国证券交易委员会(SEC)的各类文件和年度报告等。因此,这项分析依赖于公司的披露信息,这意味着,实际数据有可能更高。
此外,CRL数量的变化应该在药品申报数量略有增加的大背景之下进行解读:FDA最新发布的处方药申报者付费法案(PDUFA)报告显示,2020年,新药申请(NDA)和生物制品许可申请(BLA)的总数量达到174份,而2019年为156份,2018年为159份。
药物审评似更严格
即使CRL数量并没有增加,也有其他理由认为FDA可能在多年以来的宽松处理之后采取高压的态势,比如出人意料地推迟了对珐博进/阿斯利康的罗沙司他(roxadustat)的审批。
与此同时,艾伯维开发的JAK抑制剂Rinvoq用于银屑病关节炎和特应性皮炎的审评时间被延长了3个月,因为此类药物的安全性正在受到严格的审查。
其它两种JAK药物(辉瑞的Abrocitinib与礼来的Olumiant)用于特应性皮炎的审批决定不久后就会产生,FDA在这方面的立场应该很快就会变得明朗起来。
FDA发生的明显变化,让Leerink公司分析师杰弗里·博格斯(Geoffrey Porges)最近将6家生物制药公司的评级下调至表现平平。其指出,FDA对药物的审评更具挑战性,再加上美国联邦贸易委员会对医药并购进行更加严格的审查,这些都将导致生物制药行业面临艰难的环境。
这也许不是一件坏事。在没有明确的有效性和安全性的前提下,FDA应该不会批准药物,并且也是通过树立高标准履行了它的职责。
Acadia公司或许就是FDA收紧药物审评要求的一个例子。该公司的Nuplazid是第一种也是唯一一种批准用于与帕金森病精神病相关的幻觉和妄想的药物,但该药收到治疗与痴呆相关的精神病相关幻觉和妄想的补充新药申请的CRL并不让人意外,因为FDA在3月份已经表示其提交的文件资料存在缺陷。让人感到惊讶的是,FDA认为Acadia的Ⅲ期试验Harmony有缺陷。对于其它生物制药公司来说,这可能是一个令人担忧的事态。
根据Acadia的说法,FDA此前已经认可Harmony试验将对与痴呆症相关的大范围精神病人群进行分析,该试验达到了主要终点,但是FDA现在却说某些痴呆症人群缺乏统计学意义,并且不常见的痴呆症亚型患者人数不足。
FDA还认为,Acadia的Ⅱ期019研究并不充分或者未得到良好控制,这项研究用于支持所提交的申请材料。从好的方面来说,FDA没有提出任何安全方面的担忧。
Stifel公司的分析师表示,Acadia将不得不在这方面再开展一次甚至两次试验。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






