特色原料药第一大国 最后一公里怎么走?
发布时间:2021-05-26 18:34:37作者:本报特约撰稿 边界来源:医药经济报
想要成为原料药第一大国,原料药产业就必须以出口为导向。目前,我国已经是大宗原料药出口的第一大国。但是,在特色原料药方面,一直以来都是印度占优。
疫情之后,我国在特色原料药领域也有望迎来第一大国的机会,赶超特色原料药排名第一的印度只有一步之遥。那么,要跨越这“一步之遥”,立项应该如何考量?
中国原料药强在哪?
整体出口量稳步增长,亚洲权重提升
近年来,我国原料药出口规模持续扩大。根据中国医药保健品进出口商会公布的数据,2019年,我国原料药出口量迈入千万吨级门槛,达到1011.85万吨,同比增长8.83%,出口均价同比上涨3%,表现为量价齐升的良好态势。2020年,出口量约1088万吨,同比增长约7.5%,但均价同比有所下滑。
从出口地分布情况看,根据2019年数据,我国原料药共出口到189个国家和地区。主要集中于亚洲、欧洲、北美三大市场,合计占据我国原料药出口总额的89%。其中,我国对亚洲市场出口金额占比达47.25%,同比提升约1.5个百分点;相较之下,受中美贸易摩擦影响,2019年我国对北美出口金额占比为13.41%,同比减少约1.5个百分点;对欧洲出口金额占比28.09%,基本保持稳定。可见,我国原料药出口亚洲的权重越来越高,而出口北美的权重减少。
大宗原料药全球第一,难免遇周期性价格波动
现阶段,我国是全球最大的原料药生产地之一,也是全球第一大原料药出口国,在国际市场上占据着重要地位。
不过,我国第一大原料药出口国的地位,是靠大宗原料药撑起来的。
大宗原料药指市场需求相对稳定、应用较为普遍、规模较大的传统药品原料药,主要有抗生素类、维生素类、氨基酸类、激素类等。一般而言,大宗原料药各厂商的生产工艺、技术水平差别并不明显,生产成本控制是其竞争的主要手段,毛利率相对较低。在盈利能力方面,由于大宗原料药在技术等方面已经较为成熟,产品较为同质化,因此其价格主要受到供给、产能、原材料价格的周期性变动影响,往往呈现出周期性价格波动。
由于传统大宗原料药技术门槛低,国内传统大宗原料药生产企业数量在前期高速增长,产量一度上升至近350万吨,导致国内传统大宗原料药产能过剩。2018年开始,国内传统大宗原料药产量开始下降,2019年产量为262.1万吨。
特色原料药自产自销为主,疫情后有望全球问鼎
特色原料药是区别于大宗原料药的范畴,是用于特定药品生产的原料药,一般指原研药厂的创新药在药品临床研究、注册审批及商业化销售等各阶段所需的原料药以及仿制药厂商仿制生产专利过期或即将专利过期药品所需的原料药。医药中间体是用于药品合成工艺过程中的一些化工原料或化工产品。通常,原料药企业采购医药中间体后,在原料药企业合成至少要多于两步反应。
一直以来,我国的特色原料药产业都是自产自销为主,大部分中小企业用于国产替代进口。鉴于旧注册分类3类的原料药申报要和制剂关联,国内特色原料药产业和国内制剂并不存在明显的上下游关系。2016年国家推行原料药关联申报制度和2018年仿制药集中带量采购,才推动了国内仿制药产业链供给侧升级。
从US DMF及Eu COS申报情况看,在特色原料药领域,中国已经超越美国及EU TOP5,成为全球第二大DMF申报数的国家。疫情状态下,中国赶超特色原料药排名第一的印度,似乎只有一步之遥。
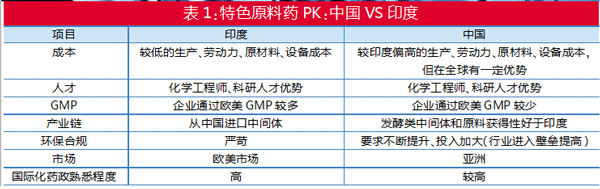
此前,印度特色原料药排名第一,其优势竞争因素包括:较低的生产、劳动力、原材料、设备成本,化学工程师、科研人才优势,企业通过欧美GMP较多等。因此,印度特色原料药市场以欧美为主,而中国特色原料药出口以亚洲为主。
新冠疫情后,印度的原料药市场供应自身难保,2020年5月印度政府就已经限制26种活性药物成分(API)和由它们制成的药物出口,包括扑热息痛,优先供应国内需求,因为新冠肺炎疫情已对供应链造成了严重破坏。
特色原料药立项考量
特色原料药根据化学小分子的专利期分为三种类型:一是专利药原料药及中间体;二是首仿药及原研药物处于专利保护后期的产品的原料药及中间体;三是无专利保护且技术成熟的原料药。对于这三种不同的特色原料药,立项需要区别对待。
【标的1】 专利药的原料药及中间体
立项考量:往往需要过欧美GMP的厂房,高要求的人才配备;合作方考察周期长,且可能放“烟幕弹”
第一种情况为专利药原料药及中间体。对于这类原料药,目前主要为拥有专利的客户选择定制的模式。定制模式主要有两种:合同定制生产模式(CMO)和合同定制研发生产模式(CDMO)。
合同定制生产模式(CMO)通常是指国际大型医药企业对原料药代工企业现场审计评估合格后,与原料药代工企业签署相关保密协议,向原料药代工企业提供产品生产所需的工艺、质量控制等技术资料,由原料药代工企业组织生产并只允许向对方供货,且不得将该产品的工艺用于其它产品的生产加工。
合同定制研发生产模式(CDMO)则是依据原料药代工企业与制药企业签订的合同,原料药代工企业为其提供医药中间体或原料药定制研发生产一体化服务。在下游制剂客户药物开发阶段至商业化阶段,原料药代工企业将提供药物所需中间体及原料药的工艺研发及生产服务,包括但不限于工艺路线设计、开发及优化、工艺分析、工艺验证、安全性评估、质量研究、中试级生产、商业化生产等。在这种模式下,下游制剂客户在其新药研发及报批阶段即使用原料药代工企业的中间体或原料药,将提高其在后期商业化生产阶段对原料药代工企业中间体的采购粘性,实现长期可持续发展。
值得关注的是,CMO和CDMO往往需要接受合作方长时间的考察周期,需要符合国际大型医药企业所在国家的法规要求,对GMP的管理要求非常高。能够承接的原料药代工企业,往往需要具备通过欧美GMP的厂房,以及配备相应学历和经验的化学工程师、科研人才和技术工人。此外,合作方要求合成的原料药及中间体不一定是合作方最后使用的,有可能是合作方的“烟幕弹”。
CMO和CDMO的机会主要来自新药小分子,已经有合规资质且已经列入跨国药企的供应链名单的国内企业有可能会得到新的订单。
【标的2】 首仿药及专利保护后期的原研药的原料药及中间体
立项考量:GMP要求相对没有“标的1”高,但研发速度快是关键,对人才要求高
第二种情况是首仿药及原研药物处于专利保护后期的产品的原料药及中间体。承接这类项目的企业,要求有较强的专利破解能力,能针对专利所保护的范围和期限,根据不同的目标合成不同的原料药。
对专利期还有较长年限的产品,通常考虑的是开发以首仿为目的、应对专利挑战用的原料药。专利期快到期的则开发与原研制剂所用的原料药质量相一致的原料药。仿制药企业往往以合同定制生产模式(CMO)与原料药供应商合作。
仿制药企业选择原料药供应商后,除非国内竞争对手上市较多,原料供应商增多,仿制药企业从成本角度更换原料药供应商,否则,仿制药企业大概率不会更换原料药供应商。
这种情况下,对GMP要求相对没有第一种高,但对人才的要求较高。因为抢首仿就是要快,“快”的关键在于拥有能更快打通合成路线、绕开原研的晶型和化学合成专利成功首仿上市的原料药研发团队。通常原料药中试完成稳定性验证才会启动制剂的小试研究,因此原料药的研发进程将影响制剂的研发进度。
国内的CRO公司和有研发能力的原料药生产企业会紧盯专利,并且根据专利到期的时间倒推开发进度,从而获得订单。国内原料药企业如果能够在欧美的原料药备案数据库申请备案,会吸引国内外的仿制药企业来问询。
【标的3】 无专利保护且技术成熟的原料药
立项考量:是否出现原料药企业垄断的情况?疫情之后,海外订单有望向中国转移,如何拿到订单?有何难题?
第三种是无专利保护且技术成熟的原料药。这类原料药通常有较多企业生产,有较多原料药产品可以选择,因此仿制药企业可以直接向原料药企业采购。
但是,如果该原料药被某家原料药企业垄断控货了,那么仿制药企业就不一定能够获得最有竞争力的价格和质量最好的原料药供货,甚至可能出现垄断的原料药企业为自己(含战略合作)的企业实现原料制剂一体化而停止供货的情况。
2019年起,国家启动药品集中采购,仿制药企业进入洗牌阶段,环保限制等多因素的影响下,仿制药原料药的集中度提升。
而鉴于中国疫情管理颇有成效,主要生产地区如浙江的原料药生产企业已经复工。疫情导致海外供给不足,包括印度、意大利等原料药生产国的停工减产、限制出口,从而导致欧美规范市场部分药品的生产供给出现短缺,特色原料药的价格涨幅明显,海外订单有望向中国转移。与此同时,短时间内国际运输挑战难以解决。
延伸>>
出口欧美增量机会来了 谁的订单?如何接单?
边界
疫情之后,海外订单向中国转移
疫情之前,根据2019年的数据,我国原料药最大的出口增量市场在亚洲;而北美占比减少,欧洲出口占比保持稳定。
具体而言,对亚洲市场出口的原料药达到544.61万吨,货值159.17亿美元,同比增长15.56%,数量和金额占比分别提升约1.5个百分点,金额占比达47.25%;对北美洲出口原料药78.79万吨,货值45.18亿美元,同比减少0.37%,数量和金额分别占据我国原料药出口的7.79%和13.41%,占比相比2018年分别减少约1.5个百分点;对欧洲出口原料药207.63万吨,货值94.61亿美元,同比增长14.1%,数量和金额分别占据我国原料药出口的20.52%和28.09%,占比保持稳定。
疫情之后,随着印度、意大利等原料药生产国停工减产,欧美部分药品生产所需的原料药出现供给短缺。这些海外订单有望向中国转移。那么,谁能拿到这个订单呢?
涉及哪些品种?谁能拿到订单?
如果立志于这块出口增量,那么首先硬件基础和软件基础都要符合欧美GMP标准。鉴于疫情的缘故,欧美GMP的检查可能难以启动,出口欧美的机会更多会被过往已经通过欧美认证的企业获得。没有欧美认证的企业也可以考虑一些需求同样大但相对法规要求没有那么高的项目。
其次还要认真评估:哪些原料会因为疫情出现较大缺口?自己现有的生产条件是否符合要求?研发团队能否攻克难关?是否有成本优势?注册团队能否胜任海外注册要求?
产品方面,慢性病用药如糖尿病、高血压会是目前的“大吨位”原料药需求,印度的肿瘤仿制药市场也可能出现供应不足,造影剂市场更可能是我国的利基市场。
此外,原料药和中间体一体化会提升原料药药企的竞争力,因为中间体出口往往法规限制没那么高,更容易出口。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






