创新医械审批通道 过关率升至近五成
发布时间:2021-05-24 11:41:23作者:杨雳 许佳锐来源:医药经济报
将于6月1日起施行的《医疗器械监督管理条例》以一系列新制度、新举措全面拥抱创新,全方位鼓励创新。而自2014年《创新医疗器械特别审批程序(试行)》发布后,创新审批通道向医疗器械企业开放已迈入第8年。截至2020年年底,超过300项医疗器械产品进入了国家级创新器械审批程序,其中99项获批上市。对医疗器械实行创新特别审批,开通绿色通道,极大地提升了创新医疗器械审查效率。
创新通道四大要求
为加快创新医疗器械的上市速度,尽快实现进口替代,助力国内产业升级,让更多的创新产品快速使大众受惠,我国发布了一系列政策文件。2014年2月,原食药监管总局发布了《创新医疗器械特别审批程序(试行)》,首次为创新医疗器械设置特别审批通道。2018年11月,国家药监局发布新版《创新医疗器械特别审批程序》,完善了适用情形、审查方式和通知形式,细化了申请流程并提升了创新审查的实效性。
根据《创新医疗器械特别审批程序》规定,同时符合下列四点的产品属于创新医疗器械:
1.申请者在中国依法拥有申报产品核心技术的发明专利权,或者依法通过受让取得在中国发明专利权或其使用权;或者核心技术发明专利的申请已由国务院专利行政部门公开。
2.已完成该产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
3.产品主要工作原理/作用机理为国内首创,产品性能或安全性与同类产品比较有根本性改进,技术上处于国际领先水平。
4.该产品具有显著的临床应用价值。
获批创新医械产品逐年增加
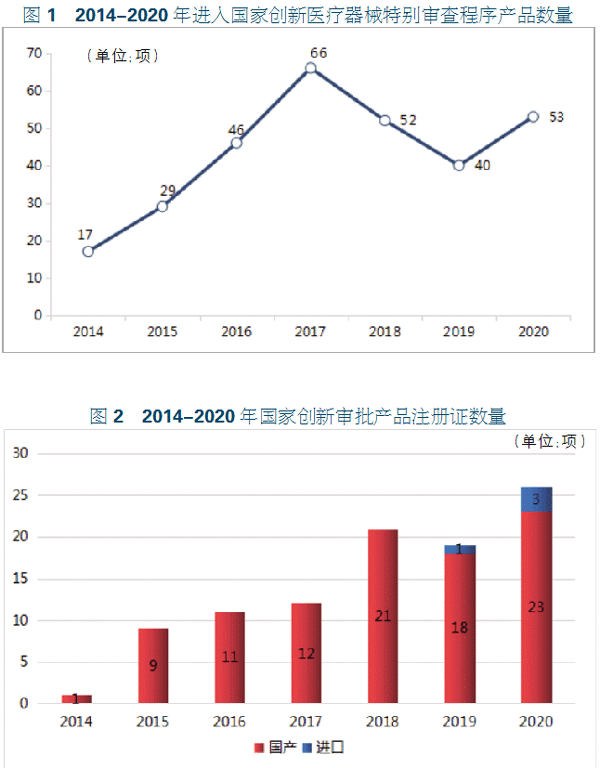
截至2020年12月31日,超过300项医疗器械产品进入了国家级创新器械审批程序。自2014年以来,医械企业进入国家创新医疗器械产品申请程序的数量在2017年达到顶峰。2018年国家药监局新修订《创新医疗器械特别审批程序》,创新审查程序的内容和流程有所调整,适用情形、审批标准更加严格规范,导致进入审批程序产品数量减少。2019年进入创新审批程序的医疗器械为40项,2020年回升至53项。
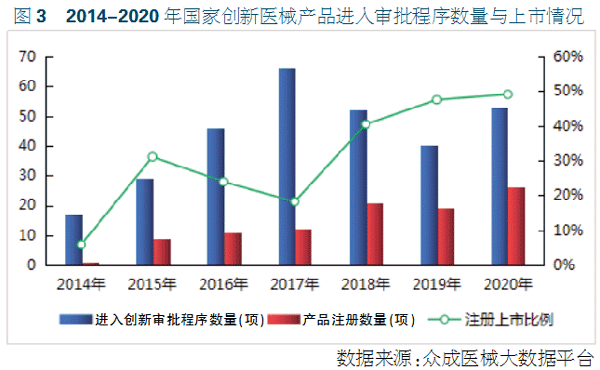
截至2020年12月31日,批准发布的国家创新审批产品注册证总数为99项。2014年创新特别审批开始实施后,获批的国家创新医疗器械产品逐年增加,2020年获批产品数量为26项,其中进口产品数量为3项。2019年,首个进口医疗器械产品获得国家创新审批产品注册证。
从进入审批通道与完成注册上市的比例来看,2014年进入国家创新医疗器械审批程序的产品数共17项,有1项完成产品注册,比例仅为5.9%。2020年这一比例达到49.1%,意味着每两项进入创新医疗器械审批程序的产品中,就有一项获得产品注册证。
☆☆★小结★☆☆
我国高端医疗装备短板亟待补齐,需加快关键核心技术攻关,突破技术装备瓶颈,实现高端医疗装备自主可控。在高值耗材带量采购等行业政策驱动下,国内医疗器械行业正在进入创新时代。截至目前,国家级创新医疗器械产品已经突破100项。随着国内创新医疗器械特别审批经验积累和流程优化,在人工智能、医疗软件以及手术机器人等亟需实现国产替代的领域,创新产品的不断涌现将常态化。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






