受理号与品种数上扬 国内化药改良新药受青睐
发布时间:2021-04-19 11:03:32作者:何乐玥 刘鑫荣来源:医药经济报
2016年3月4日我国发布并实施的《化学药品注册分类工作改革方案》中的改良型新药与2020年7月1日起施行的《药品注册管理办法》中的化学药改良型新药(以下简称:化药改良新药)的分类说明情形基本一致,均强调了应具有明显的临床优势。
本文从近3年来CDE受理的化药改良新药的分类及其数量进行分析。
四个亚类
化药改良新药(化学药2类)分为四个亚类:
2.1类为已知活性成分的光学异构体,或对已知活性成分成酯、成盐,或改变已知盐类活性成分的酸根、碱基或金属元素、形成其他非共价键衍生物。
2.2类为含有已知活性成分的新剂型(包括新的给药系统)、新处方工艺、新给药途径。
2.3类为含有已知活性成分的新复方制剂。
2.4类为含有已知活性成分的新适应症的药品。
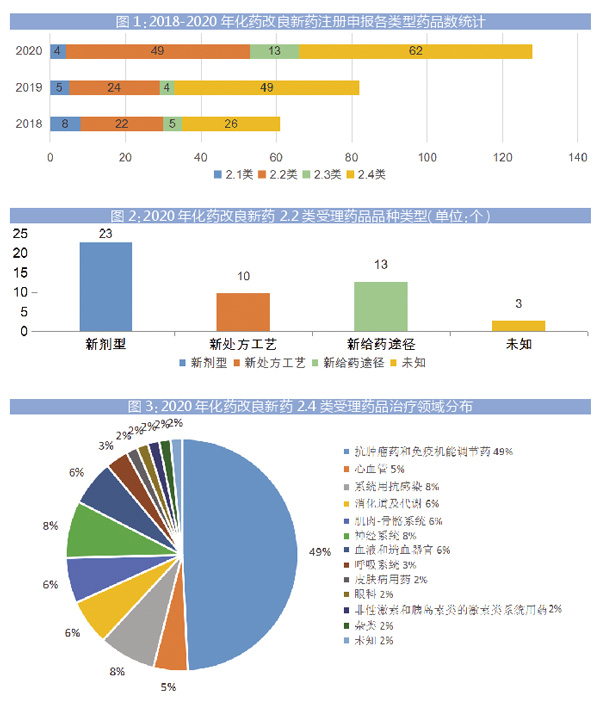
据咸达数据库,2018-2020年化药改良新药亚类申报药品品种数目(包含IND、NDA以及补充申请涉及的所有药品品种数)统计见图1。
受理号分布
2020年CDE共承办化药改良新药受理号313条(不包含补充申请,其中进口申请类型占122条),涉及128个药品品种。2019年受理号170条(不包含补充申请,其中进口申请类型占85条),涉及86个药品品种。2018年共计95条,涉及61个药品品种。2018-2020年,受理号复合年增长率为82%,受理药品品种数复合年增长率为45%。
2020年CDE共承办化药改良新药2.1类IND品种4个。2.2类IND品种42个,NDA品种7个,见图2。2.3类IND品种9个,NDA品种3个。2.4类IND品种38个,NDA品种15个。
2020年化药改良新药2.4类的200个受理号中,治疗领域为抗肿瘤和免疫机能调节的药品就占了133条,涉及31个药品品种,其次是心血管系统、消化道及代谢、系统用抗感染药,详见图3。
品种数逐年提升
国内药品研发机构对化药改良新药的药品注册申请品种数目逐年明显提升,主要集中在已上市药品活性成分的新剂型(2.2类)和新适应症(2.4类)。
新剂型以普通片剂或胶囊剂改为缓释片、控释片、颗粒剂、口崩片以及口溶膜为主。注射剂化药改良新药2.2类的注册申报以新处方工艺的特殊剂型为主,如盐酸米托蒽醌脂质体注射液、盐酸伊立替康脂质体注射液、注射用紫杉醇胶束。
新适应症主要是原研厂家的化学药品1类新药上市后,进行已上市药品的新适应症的药品注册申报,往往会出现一个药品针对多个适应症申请临床试验批件的情况。尤其是抗肿瘤药物,如盐酸安罗替尼胶囊、马来酸吡咯替尼片,以期获得更大的临床使用范围,从而拓展市场。
与创新药相比,化药改良新药可减少研发投入、降低研发风险、缩短研发周期,是当前新药研发的热点方向之一。这类新药选题立项的难点在于,项目应具有明显的临床优势。
可喜的是,2020年6月,CDE发布了“关于公开征求《化学药品改良型新药临床试验技术指导原则(征求意见稿)》意见的通知”,随着未来该指导原则的正式公布,将明确“具有明显的临床优势”的定义、临床试验设计与评价的原则,将进一步促进国内化药改良新药的研发。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






