RA生物药热度渐退 JAK机会来了
发布时间:2021-04-16 18:14:30作者:李勇来源:医药经济报
近30年来,类风湿关节炎(RA)的治疗选择已大大增加,但由于发病机制复杂,目前该病尚无法治愈。临床上已有多种类风湿关节炎疗法,包括传统抗风湿药(csDMARD)、糖皮质激素、生物制剂DMARD(bDMARD)和靶向合成DMARD(tsDMARD)。
目前国内外类风湿关节炎临床治疗指南推荐以甲氨蝶呤为代表的csDMARD作为类风湿关节炎治疗的标准,但对于csDMARD不能控制的患者,联合使用bDMARD或tsDMARD尤为必要,而且后两类药物也逐渐成为主角。
生物药:赛道拥挤
bDMARD主要靶向于病情发展中的炎症细胞因子,如肿瘤坏死因子α(TNF-α)、白细胞介素1(IL-1)、白细胞介素6(IL-6)、白细胞介素17(IL-17)、白细胞介素23(IL-23)等,或直接靶向细胞表面受体(CD4、CD5、CD7)。目前已用于临床的bDMARD包括TNF-α抑制剂、IL-6拮抗剂、抗CD20单抗、IL-1拮抗剂等。
TNF-α
英夫利西单抗
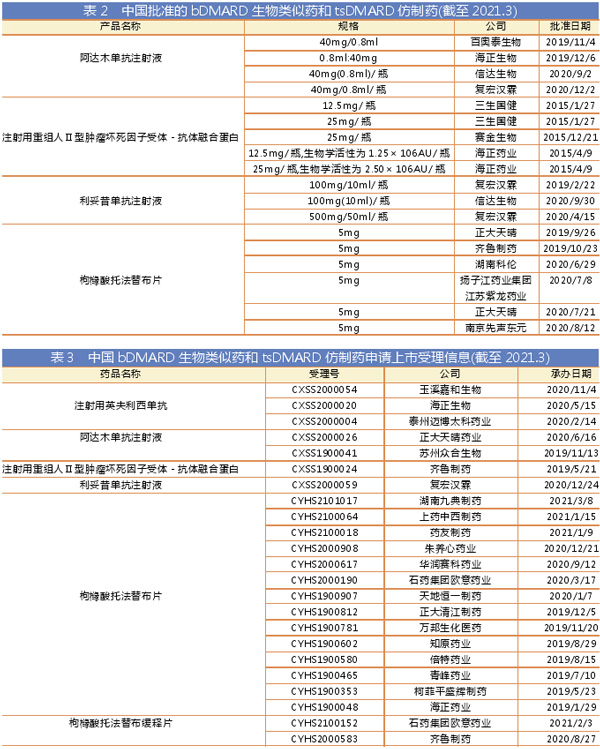
杨森的Remicade/类克(infliximab/英夫利西单抗)是第一个获得FDA批准的TNF-α抑制剂,1998年最初批准用于克罗恩病,2004年获批用于类风湿关节炎,2005年获批用于溃疡性结肠炎。研究表明,英夫利西单抗停药率高于其他TNF-α抑制剂,如阿达木单抗和依那西普。
英夫利西单抗原研药2006年进口中国,目前国内尚无该品种生物类似药获批,其中,泰州迈博太科药业、海正生物、玉溪嘉和生物已提交注射用英夫利西单抗生物类似药上市申请。
阿达木单抗
艾伯维的Humira/修美乐(adalimumab/阿达木单抗)2002年12月获FDA批准用于RA治疗,其治疗反应率与甲氨蝶呤相当,并且在用作联合疗法时具有双重功效。该品种多年来一直霸占着全球最畅销药物榜首的位置。
阿达木单抗原研药2010年进口中国,目前国内已有4家企业获得该品种生物类似药批准文号,分别是:百奥泰、海正生物、信达生物和上海复宏汉霖。另有正大天晴、苏州众合生物2家企业已提交阿达木单抗注射液生物类似药上市申请。
戈利木单抗
杨森的Simponi/欣普尼(golimumab/戈利木单抗)2009年被FDA批准用于活动性类风湿性关节炎。戈利木单抗还获准用于银屑病性关节炎和强直性脊柱炎。戈利木单抗每月皮下给药一次,这使其优于其他TNF抑制剂,后者表现出相当复杂的剂量要求。
戈利木单抗原研药2017年进口中国,目前国内暂无该品种生物类似药上市和上市申请,不过今年2月19日百奥泰的戈利木单抗生物类似药BAT2506 首次公示启动国际多中心Ⅲ期临床,这是国内唯一一款进入临床的戈利木单抗生物类似药。
培塞利珠单抗
优时比的Cimzia/希敏佳(certolizumab pegol/培塞利珠单抗)是一种人源化PEG化(聚乙二醇)单克隆抗体,2009年5月获FDA批准用于治疗类风湿性关节炎。由于不存在Fc片段,无法与Fc受体相互作用并刺激补体依赖性细胞毒性(CDC)或抗体依赖性细胞毒性(ADCC),这些毒性反应是使用英夫利西单抗和阿达木单抗的常见风险。
培塞利珠单抗原研药2019年进口中国,目前国内暂无该品种生物类似药上市和上市申请。
依那西普
安进/辉瑞的Enbrel/恩利(etanercept/依那西普)是获FDA批准的第一个融合蛋白,1998年获批用于治疗类风湿性关节炎。1999年,该批准扩展至青少年类风湿性关节炎,2002年扩展至银屑病关节炎,2003年扩展至强直性脊柱炎,2004年扩展至斑块状银屑病。
依那西普原研药2010年进口中国,目前国内已有3家企业获得该品种生物类似药批准文号:三生国健、赛金生物及海正药业(重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白皆为依那西普生物类似药)。此外,齐鲁制药已提交该品种生物类似药上市申请。
CTLA4-Ig
百时美施贵宝的Orencia/恩瑞舒(abatacept/阿巴西普)2005年获FDA批准用于治疗成人类风湿性关节炎,以单药或与除TNF抑制剂以外的DMARD同时使用,是全球风湿免疫领域第一个、也是目前唯一的T细胞选择性共刺激免疫调节剂,由人细胞毒性T淋巴细胞相关抗原4(CTLA-4)细胞外结构域与免疫球蛋白IgG1的Fc区组成。
2020年1月,原研药进口中国(由先声药业与百时美施贵宝共同开发)。目前国内暂无该品种生物类似药上市和上市申请。
CD20
基因泰克(罗氏)的Rituxan或Mabthera(美国以外)/美罗华(rituximab/利妥昔单抗)最初获FDA批准用于治疗非霍奇金淋巴瘤和慢性淋巴性白血病,后来适应症扩展到自身免疫性疾病,如类风湿性关节炎。
尽管该品种已进口中国,但原研利妥昔单抗的类风湿关节炎适应症仅在美国和欧盟获批,在中国尚未获批。而已获得该品种生物类似药批文的上海复宏汉霖和信达生物获批适应症也为非霍奇金淋巴瘤等肿瘤适应症。2020年12月17日,复宏汉霖宣布,国家药监局正式受理了利妥昔单抗生物类似药用于新适应症类风湿性关节炎的上市申请。
IL
Biovitrum公司的Kineret(anakinra/阿那白滞素)是一种白介素(IL)-1受体拮抗剂,2001年获FDA批准适用于类风湿样关节炎治疗。目前该品种原研药未进口中国,亦无生物类药上市或者申请上市。
罗氏的Actemra/雅美罗(tocilizumab/托珠单抗)是一种免疫球蛋白IgG1(γ1,κ)子类重组人源化抗-人白介素6(IL-6)受体单抗,2010年1月获FDA批准用于治疗中度至严重活动性类风湿性关节炎。托珠单抗的靶标主要针对免疫系统特异阶段,即类风湿性关节炎发病过程中引起关节损害的炎症阶段。原研药2019年进口中国,目前国内暂无该品种生物类似药上市和上市申请。百奥泰生物的托珠单抗生物类似药正在临床开发中。
赛诺菲的Kevzara(Sarilumab)是首个直接靶向IL-6受体复合物α亚基(IL-6R α)的全人源化单克隆抗体,2017年获FDA批准用于既往接受一种或多种DMARD(例如甲氨蝶呤)治疗缓解不足或不耐受的中度至重度活动性类风湿性关节炎成人患者。目前该品种原研药未进口中国,亦无生物类药上市或申请上市。
靶向合成药:JAK抑制剂登场
辉瑞的Xeljanz/尚杰(tofacitinib/托法替布)2012年11月获FDA批准用于类风湿性关节炎治疗,是FDA批准的首款JAK抑制剂。原研药2017年进口中国,目前正大天晴、齐鲁制药、湖南科伦、扬子江药业、南京先声东元开发的托法替布仿制药已获批上市,还有多家仿制药正在申请上市。
礼来的Olumiant/艾乐明(baricitinib/巴瑞替尼)2018年7月获FDA批准治疗对甲氨蝶呤反应不足或不耐受的中度至重度成人活动性类风湿关节炎。巴瑞替尼可以用作单一疗法或与甲氨蝶呤等其他药物联合使用。原研药2019年进口中国,目前暂无仿制药上市或申请上市。
艾伯维的Rinvoq(upadacitinib/乌帕替尼)2019年8月获批用于对甲氨蝶呤应答不足或不耐受(MTX-IR)的中度至重度活动性类风湿性关节炎成人患者。原研药正在进口注册申请中,目前暂无仿制药上市或申请上市。
小结
谁是王者?
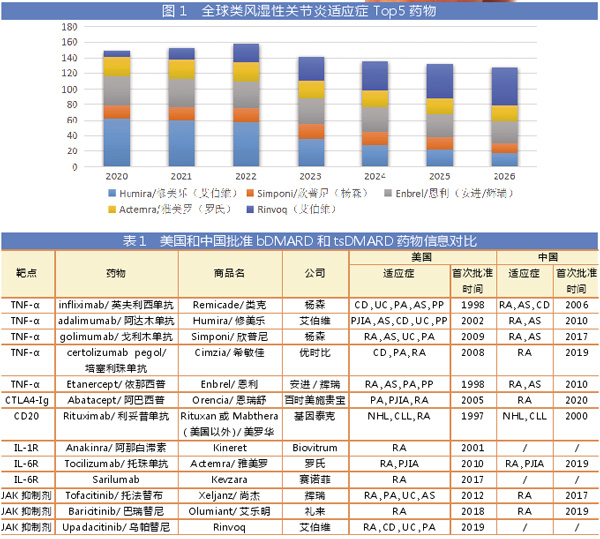
随着竞争的加剧,以及专利到期后生物类似药的上市,类风湿性关节炎生物药市场将出现整体快速下滑的趋势。而在以JAK为代表的靶向合成药领域,辉瑞的Xeljanz/尚杰作为首款JAK抑制剂上市后市场表现可圈可点,但近年屡屡遭受安全性困扰,从而为后来者艾伯维的Rinvoq提供了赶超机会。
根据市场调研机构Evaluate Pharma预测,到2026年,艾伯维的Rinvoq将成为全球类风湿性关节炎领域最畅销的药物,销售额预计达到50.21亿美元,远超Humira/修美乐(艾伯维)的16.93亿美元、Simponi/欣普尼(杨森)的13.38亿美元、Enbrel/恩利(安进/辉瑞)的28.64亿美元、Actemra/雅美罗(罗氏)的19.26亿美元。
尽管艾伯维的Rinvoq销售增长难以弥补Humira/修美乐专利到期后的损失,但在类风湿性关节炎领域,艾伯维“领头羊”地位仍然难以撼动。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






