政策推动 “孤儿药”加速可及
发布时间:2021-04-13 16:05:17作者:本报记者 张蓝飞来源:医药经济报
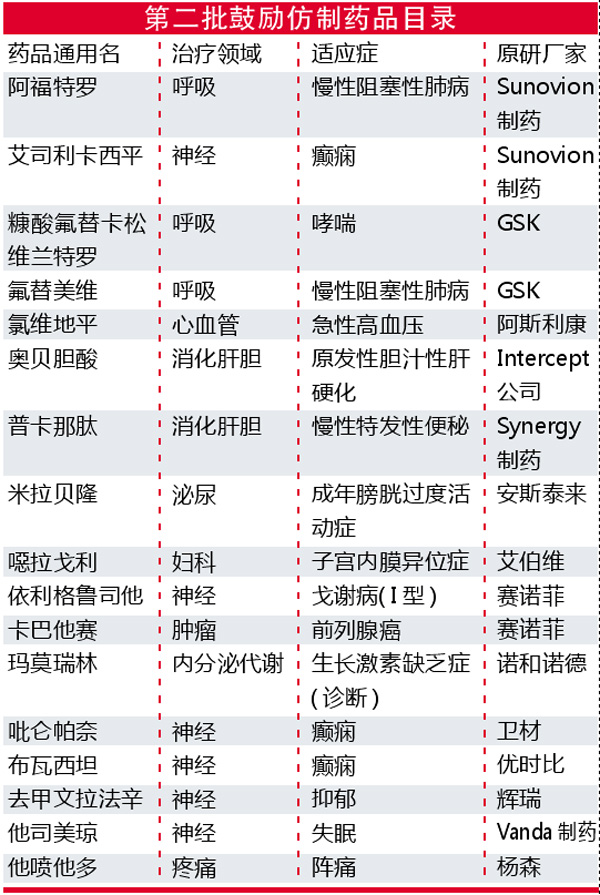
国家卫生健康委、科技部等部门日前联合发布《关于印发第二批鼓励仿制药品目录的通知》。新目录公布17种药品,涉及原发性胆汁性肝硬化、癫痫、便秘等众多适应症,奥贝胆酸、依利格鲁司他、玛莫瑞林、他司美琼等多款罕见病药物纳入,引发市场关注。行业普遍认为,在审评审批制度改革、医保支付制度调整等政策支持下,罕见病药物可及性大幅提升。
真实世界研究助力
早在2018年12月,国家卫健委、发改委等多部门联合印发《关于加快落实仿制药供应保障及使用政策工作方案》,明确根据临床用药需求,自2019年6月底前,发布第一批鼓励仿制的药品目录,引导企业研发、注册和生产;自2020年起,每年年底前发布鼓励仿制的药品目录。在目录中,罕见病“孤儿药”均为政策重点支持的药物研发领域。
一直以来,罕见病药物研究挑战重重,因为可供研究人员使用的资源很少。有用的信息遍布在各地医院,研究人员从医院收集这些信息,要花费很多时间和精力,也没有足够的资金支持这项工作,有时候患者并不知道自己的健康信息正在被使用。
事实上,打破当前罕见病的“信息孤岛”,对于建立多方合作至关重要。日前,曙方医药与左手医生签订战略合作协议,双方将聚焦罕见病领域,联手建设罕见病全程智慧管理平台,促进罕见病医患高效连接,为罕见病医生提供临床科研管理和患者居家管理支持,以期惠及中国更多罕见病患者。
罕见病开发新药和新疗法的挑战之一是,如何获得足够的信息,以找到正确的治疗方法。曙方医药市场和客户发展副总裁吴超认为,罕见病真实世界研究对患者、研究者、循证医学和药企都是有意义和价值的,对于未来健康和医疗的推动不可低估,所以临床研究要回归真实世界,需要科学系统地利用真实世界数据,从而达成真实世界研究。
真实世界的数据积累对于提高罕见病药物转化意义重大。去年,国家药品监管部门先后发布《真实世界证据支持药物研发与审评的指导原则(试行)》《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》以及《用于产生真实世界证据的真实世界数据指导原则(征求意见稿)》等多个指导原则,持续推动基于真实世界证据的科学监管实践和试点工作。
左手医生创始人兼CEO张超在采访中表示,根据不同疾病的特征、治疗手段的可及性、目标人群、治疗效果和其它与临床研究相关的因素等,监管部门对真实世界证据在罕见病药物审评审批和临床评价中的作用愈发重视并提出了指导原则,未来真实世界证据将会进一步促进和优化罕见病药物的研发和监管进程。
药物可及性将改善
罕见病有近8000种,对应的特效药并不多,而特效药往往会给患者造成严重的经济负担。相对其他药物,罕见病药物在一定区域内的用量极小,对其生产、流通和使用都带来诸多不利影响。除政策因素外,罕见病药物的支付能力挑战也在持续关注中得到缓解。
值得关注的是,有些罕见病用药价格昂贵,对医疗机构的各种考核指标会带来不利影响,导致部分医疗机构不太愿意采购和储备高价格的罕见病药品。
此前,已有业内专家建议,区域中心集中供应的模式可最大程度保证药物质量,并能确保及时供应,患者还可以通过“互联网+医院”进行复诊,通过物流配送获得相应的药品。
上海市卫生和健康发展研究中心主任金春林曾公开表示,罕见病支付端应当探索“1+N”的多方共付保障模式:社会公共医疗保险为基础,同时动员大病医保、医疗救助、帮扶、政策性商业保险、患者共付等“N”种形式共同解决这个问题。
截至目前,“多方共付”的保障模式已经在浙江、山东、成都、广州等省市探索推进。在近期举行的“向阳而生 聚力同行——SMA健康中国行”公益项目落地仪式上,伴随普惠型商业补充健康保险在全国多个城市延伸保障范围,以脊髓性肌萎缩症(SMA)为代表的一大批罕见病药物,已经可以享受较高比例的一站式报销。
北京市美儿SMA关爱中心执行总监邢焕萍介绍:“目前在美儿的数据库中,广州市登记在册的SMA患者有42名,其中已开始药物治疗的广州患者初步统计有14名。广州范围内参保‘穗岁康’的患者逐步增加,广州市SMA患者的治疗现状正在得到改善。”
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






