应急审批程序修订 境内三类和进口医械审批会否提速?
发布时间:2021-03-18 16:57:52作者:陈颖诗 许佳锐 杨雳来源:医药经济报
近日,国家药监局组织对《医疗器械应急审批程序》(国食药监械〔2009〕565号)进行修订,形成《医疗器械应急审批程序(修订稿征求意见稿)》(以下简称《意见稿》)向社会公开征求意见,意见征求截止至4月15日。
根据《意见稿》的要求,该程序适用于突发公共卫生事件应急所需,且在我国境内尚无同类产品上市,或虽在我国境内已有同类产品上市,但产品供应不能满足突发公共卫生事件应急处理需要,并经国家药品监督管理局确认的境内第三类和进口医疗器械的审批。
那么,《医疗器械应急审批程序》的修订,会给境内三类和进口医械审批带来怎样的影响?
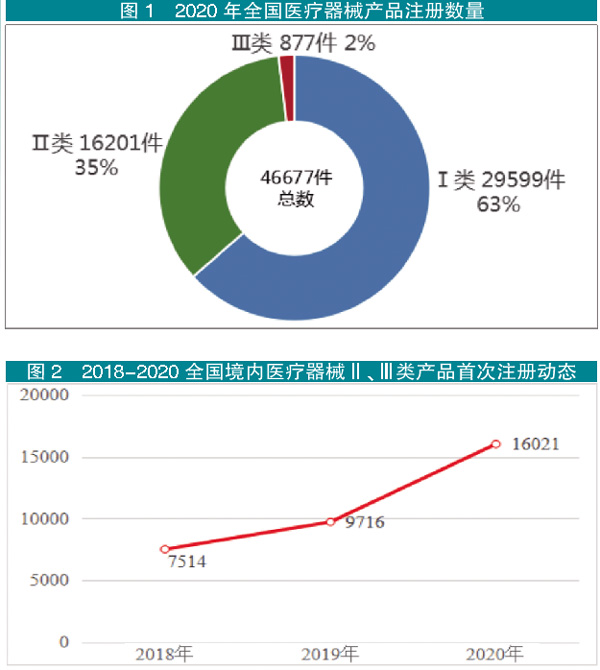
境内Ⅲ类医械产品注册数高速增长
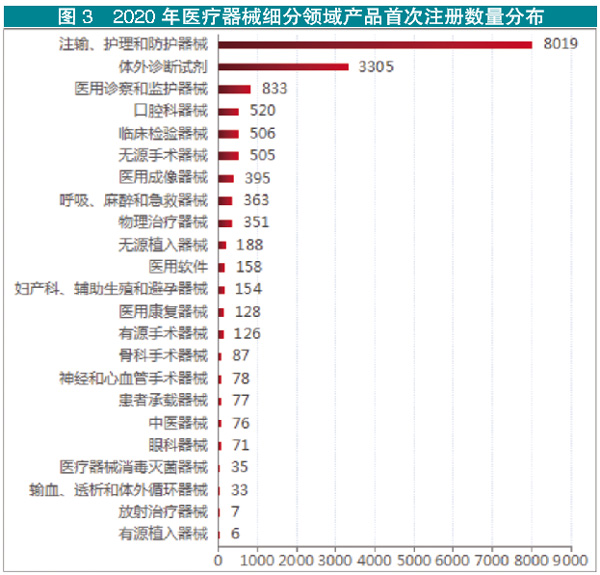
据统计,截止至2020年12月底,2020年全国境内医疗器械产品备案、注册共计46677件,较上一年同期(31266件)增长49.3%。其中,Ⅲ类注册877件。除延续注册、信息变更外,境内医疗器械Ⅱ、Ⅲ类产品首次注册共计16021件(以下简称“首次注册”),同比增长64.9%。其中,Ⅲ类产品首次注册865件。
2018-2020年,全国境内医疗器械Ⅱ、Ⅲ类产品首次注册数量保持高速增长。从细分领域看,Ⅱ、Ⅲ类产品首次注册数量排名第一的是注输、护理和防护器械,共计8019件;排名第二的是体外诊断试剂,共计3305件;后续依次为医用诊察和监护器械,口腔科器械,临床检验器械,无源手术器械,医用成像器械,呼吸、麻醉和急救器械,物理治疗器械,无源植入器械。
进口Ⅱ、Ⅲ类产品注册数减少24.6%
在进口产品方面,截止至2020年12月底,全国进口医疗器械产品共计26713件,较2019年底(28617件)减少1904件,降幅6.7%。现有进口产品Ⅲ类7966件。
2020年度全国进口医疗器械Ⅱ类、Ⅲ类产品首次注册共计493件,同比减少161件,降幅24.6%。
1.进口中高端器械大幅减少
对比2019年底产品数量情况,2020年进口Ⅰ类产品数量小幅提升,而Ⅱ类、Ⅲ类产品(中高端器械)均出现大幅下降,Ⅲ类产品降幅超15.1%。
2.低端器械备案数量缩减一半
对比2019年首次注册及备案数据,2020年度进口产品备案数量为713件,同比减少702件,缩减49.6%;而Ⅱ类、Ⅲ类产品首次注册数量各缩减21.3%、12.4%。
常态时期审批影响不大
从《意见稿》可以看出,应急审批程序主要为了应对突发的公共卫生应急事件。文件提到,对于经国家药品监督管理局确认进行应急审批的医疗器械,如委托药品监督管理部门医疗器械检验机构开展注册检验的,相关医疗器械检验机构应当在接收样品后24小时内组织开展医疗器械注册检验。对于应急审批医疗器械,相应的省、自治区、直辖市药品监督管理局应当在接到国家药品监督管理局通知后2日内组织开展质量管理体系考核。对于境内和进口第三类应急审批医疗器械注册申请受理并确认缴费转入技术审评阶段后,国家药品监督管理局应当在10日内完成技术审评;技术审评结束后,在3日内完成行政审批。对于进口第二类应急审批医疗器械注册申请受理并确认缴费转入技术审评阶段后,国家药品监督管理局应当在5日内完成技术审评;技术审评结束后,在3日内完成行政审批。
除了对药监管理部门有快速审批的要求外,申请企业同样需要具备包括研发、生产、注册申请等方面在内的快速推进机制:对于应急审批医疗器械,自确认应急审批之日起60 个工作日内,如注册申请人无法按照注册要求完成注册申报资料准备并获得注册申请受理,则不再按照应急审批办理。
由此可见,《医疗器械应急审批程序》的更新,对于常态时期境内三类和进口医疗器械的审批并不会带来太大影响。

此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






