IO研发竞赛第二波 谁有PD-1级重磅潜质?
发布时间:2021-03-18 16:08:29作者:李勇来源:医药经济报
第一波肿瘤免疫疗法(IO)研发的靶点瞄准免疫检查点,并产生了像默沙东Keytruda(pembrolizumab,帕博利珠单抗)和百时美施贵宝Opdivo(nivolumab,纳武利尤单抗)这样的PD-1抑制剂“重磅炸弹”。
如今,新一波IO浪潮靶点包括第二代检查点抑制剂以及与多种新兴免疫靶点相互作用的药物。生物制药行业能否在新一轮肿瘤免疫疗法竞跑中找到PD-1抑制剂潜质的新“重磅炸弹”呢?
靶向肿瘤微环境
涉及多个靶点,投资活跃
针对肿瘤微环境开发相应的免疫疗法已成为近年来研究的热点之一。
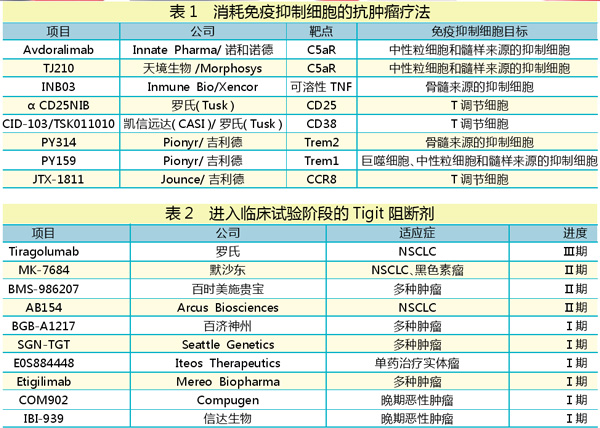
2020年9月1日,吉利德宣布与Jounce Therapeutics达成协议,获得后者JTX-1811项目的独家授权。
JTX-1811是一种处于临床前的单抗,旨在选择性清除具有免疫抑制能力的肿瘤浸润性调节性T(TITR)细胞(Treg)。JTX-1811的靶点CCR8是一种在TITR细胞上富集的趋化因子受体,该受体通常可帮助肿瘤逃避免疫系统的检测。靶向CCR8可以通过耗竭肿瘤浸润的Treg细胞,以增强抗肿瘤免疫。
根据协议条款,吉利德将向Jounce支付8500万美元预付款,并进行3500万美元的股权投资。未来,Jounce有望基于临床、监管和商业里程碑获得高达6.85亿美元的后续付款。
事实上,生物制药公司对Treg的兴趣正不断增加。2018年9月,罗氏以8100万美元的价格收购了Tusk Therapeutics。Tusk是一家研究Treg的公司,其在研靶向Treg靶点的CD25抗体药αCD25NIB,与PD-1/L1联合有望大大提高治疗效果;靶向CD38的在研抗体药CID-103/TSK011010是一款全新的免疫检查点抑制剂,很可能成为PD-1/L1之后的新一代药物。2019年4月,凯信远达医药(CASI)从Black Belt Therapeutics公司(Tusk新组建公司)引进TSK011010。
TJ210是天境生物授权自MorphoSys公司(HuCAL Platinum技术)并合作开发的一种用于治疗癌症的新型C5aR单抗。在肿瘤微环境中,C5a作为一种趋化因子,招募表达C5aR1的免疫抑制性细胞,如髓源性抑制细胞、中性粒细胞和M2型巨噬细胞等迁移至肿瘤部位,抑制机体免疫细胞对肿瘤的攻击,促进肿瘤发生及进展。2019年10月,TJ202获中国国家药品监督管理局(NMPA)Ⅱ期临床和Ⅲ期临床试验许可,适应症为复发或难治性骨髓瘤。
TIGIT阻断剂
罗氏能否反超PD-1领跑者?
新兴免疫靶点T细胞免疫球蛋白和ITIM结构域(TIGIT)目前备受关注,其同样具有PD-1重磅潜质。TIGIT在淋巴细胞上表达,与肿瘤细胞上的CD155相互作用以抑制抗癌免疫细胞。
默沙东一项Ⅰ期临床试验将TIGIT单抗MK-7684与Keytruda联合用于晚期实体瘤,可使40%患者病情稳定。MK-7684目前已启动了多项与Keytruda联合用于治疗非小细胞肺癌(NSCLC)、黑色素瘤的Ⅱ期研究项目。
作为IO领域的主要竞争者,百时美施贵宝也在TIGIT靶点进行了布局,其开发的BMS-986207正在进行单一疗法以及与Opdivo联合治疗多种肿瘤的研究。
吉利德与Arcus的交易也包括一个抗TIGIT候选抗体AB154,用于治疗非小细胞肺癌也已进入Ⅱ期临床。
然而,TIGIT阻断剂领域真正的领导者是罗氏,该公司押注TIGIT,以期扭转目前与默沙东和百时美施贵宝在IO领域竞争的落后局面。2020年5月,在美国临床肿瘤学会虚拟年会上,罗氏下属基因泰克报告称,其抗TIGIT抗体候选物tiragolumab与其已上市的PD-L1阻断剂Tecentriq(atezolizumab,阿替利珠单抗)联合,31%的非小细胞肺癌患者肿瘤缩小,轻松击败了Tecentriq单独治疗。目前tiragolumab已率先进入Ⅲ期临床。
值得一提的是,我国也有多家企业对该靶点布局。信达生物的IBI939已于2020年1月获得CDE默示临床试验许可,适应症为晚期肿瘤(血液肿瘤和实体瘤);百济神州在研TIGIT单抗BGB-A1217已在中国和澳大利亚启动BGB-A1217联合替雷利珠单抗治疗晚期实体瘤的Ⅰa/Ⅰb期临床试验。
抗CD47疗法
“别吃我”将打破僵局
越来越多证据表明,肿瘤会利用CD47逃避免疫攻击,长期以来业界也一直对免疫靶点CD47感兴趣,却迟迟难以打破僵局。问题在于,阻断CD47会导致危险的血液学副作用。
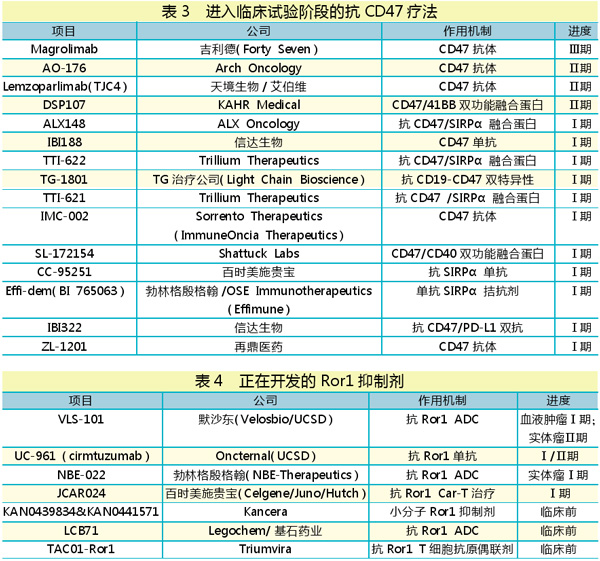
现在,多家公司表示他们的抗CD47药物已经达到理想的风险收益特征, ALX Oncology公司便是其中一员。该公司在2020年2月的C轮融资中筹集了1.05亿美元。2020年3月FDA还授予ALX148两个快速通道资格认定(FTD),用于一线治疗头颈部鳞状细胞癌,以及二线治疗HER2阳性胃或胃食管交界腺癌。目前ALX148已进入Ⅱ期临床。ALX Oncology公司7月完成了1.62亿美元的首次公开募股。
2020年9月,FDA授予吉利德首创的抗CD47单抗magrolimab突破性药物资格(BTD),用于治疗新诊断的骨髓增生异常综合征(MDS)。magrolimab是吉利德于2020年4月斥资约49亿美元收购Forty Seven后获得的。2020年欧洲血液学学会(EHS)大会上公布的数据显示,接受magrolimab与阿扎胞苷联合治疗的可评估患者(n=33)中,客观缓解率(ORR)达91%,完全缓解率(CR)达42%,且治疗耐受性良好。目前,magrolimab正在进行双盲、安慰剂对照、随机Ⅲ期ENHANCE试验,用于未经治疗的高危MDS患者。
lemzoparlimab(TJC4)是由天境生物自主研发的一款高度差异化的CD47单抗。2020年9月,天境生物和艾伯维就lemzoparlimab建立全球战略合作关系,艾伯维获得大中华区以外的开发和商业化许可权,天境生物保留中国大陆、中国香港和中国澳门开发和商业化的所有权利。目前该药已进入Ⅱ期临床。
我国信达生物、再鼎医药等也在该靶点进行布局,并已进入临床试验阶段。值得一提的是,2018年10月,信达生物重组全人源抗CD47单抗IBI188率先获得FDA临床试验批件,成为CD47单抗第一家获得FDA批准进入临床研究的中国公司。
Ror1抑制剂
两大巨头对ADC齐出手
在默沙东于2020年11月以28亿美元收购Velosbio公司仅仅一个月之后,勃林格殷格翰也以15亿美元的价格收购NBE-Therapeutics。
两个并购的目标公司的共同点是专注于开发靶向于受体酪氨酸激酶样孤儿素受体1(Ror1)的抗体-药物偶联物(ADC)。Ror1被认为是一种在多种肿瘤类型中表达的蛋白。
除了勃林格殷格翰的NBE-022和默沙东的VLS101,另一个以Ror1为目标的ADC是Legochem公司的LCB71。国内基石药业在2020年10月29日,早于默沙东和勃林格殷格翰收购案之前就进行了布局,以1000万美元的首付款拿下了LCB71在韩国以外的全球地区的独家开发和商业化授权。
在2020年12月第62届美国血液学会年会(ASH)上,两款Ror1药物(UC-961和VLS101)公布了最新的积极数据。
UC-961(cirmtuzumab)是抗Ror1单抗,其与Ibrutinib(伊布替尼)联合用于复发/难治性(r/r)套细胞淋巴瘤(MCL)或初治(TN)或r/r慢性淋巴细胞性白血病(CLL)的Ⅰ/Ⅱ期临床结果显示,MCL总体缓解率(ORR)为83%。
VLS-101的Ⅰ期临床数据显示,VLS-101治疗MCL的ORR为47%;治疗弥漫性大B细胞淋巴瘤(DLBCL)的ORR达80%。VLS-101单药和联合治疗血液或实体肿瘤的Ⅰ/Ⅱ期临床研究也在计划开展。
关于Ror1,此前一直未有积极进展。百时美施贵宝抗Ror1的Car-T项目JCAR024迟迟难以取得重大进展;Aptevo和Macrogenics似乎也放弃了靶向Ror1的双特异性抗体。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






