生物类似药批准数量盘点
发布时间:2021-03-18 15:54:33作者:灯芯来源:医药经济报
2月18日,国家药品监督管理局药品审评中心(CDE)官网发布《生物类似药相似性评价和适应症外推技术指导原则》。生物类似药一致性评价政策正式发布,对生物类似药研发和适应症外推使用正式提出明确的监管要求,并为纳入全国集采提供了质量标准。
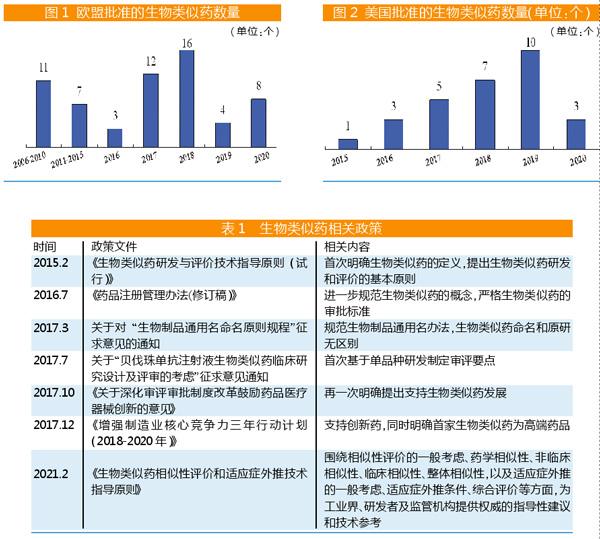
欧盟领跑,已批61个
欧盟(EMA)是国际上最早制定生物类似药监管政策的组织,早在2004年就发布了《生物类似药指南》(草案)。2005年《生物类似产品指南》(CHMP/47/04)正式生效,是世界上第一部用于生物类似药研发与评价的指导原则。
2006年4月,EMA批准首款生物类似药——诺华开发的生长激素Omnitrope(通用名Somatropin)。截至2020年底,EMA已批准61款生物类似药(以商品名计,不包含获批后撤回产品)上市,对应16个参比生物药。2017-2018年为欧盟生物类似药获批上市爆发期。阿达木单抗、聚乙二醇化非格司亭、非格司亭、曲妥珠单抗和利妥昔单抗的生物类似药获批数量均超过5个。
美国紧跟,已批29个
美国作为全球最大的药品市场,虽然其生物类似药相关概念界定和法规指南起步较晚,但近年美国政府和相关药企巨头积极消除阻力,加速生物类似药登陆美国市场,并取得了不小成效。
2014年6月,FDA受理了首例通过生物类似药途径上市的药品申请。2015年3月,山德士的非格司亭Zarxio(通用名Filgrastim-sndz)在美国上市,由此揭开美国生物类似药的序幕。2015-2020年,美国获批生物类似药数量合计为29个。其中2019年获批上市生物类似药数量最多,为10个。
美国批准的29个生物类似药涉及9个参比生物药。其中,阿达木单抗对应的生物类似药多达6个,曲妥珠单抗生物类似药也有5个。
中国加速,已批14个
近年,我国制定和颁布了多项鼓励生物类似药研发的政策。
2015年3月,原国家食品药品监督管理局(原CFDA)发布《生物类似药研发与评价技术指导原则(试行)》,首次明确生物类似药的定义,提出了生物类似药研发和评价的基本原则,对生物类似药的药学、非临床、临床研究和评价等内容提出具体要求。
2016年7月,《药品注册管理办法(修订稿)》发布,进一步规范生物类似药的概念,严格生物类似药的审批标准。
2017年7月,CDE发布关于“贝伐珠单抗注射液生物类似药临床研究设计及审评的考虑”征求意见通知,首次基于单品种研发制定审评要点。
2021年1月的国务院政策例行吹风会上,国家医疗保障局副局长陈金甫就《关于推动药品集中带量采购工作常态化制度化开展的意见》进行政策解读,明确表示生物类似药将纳入集采。
2021年2月,CDE发布《生物类似药相似性评价和适应症外推技术指导原则》,将助力国内生物类似药质量进一步提升,加速生物类似药纳入全国带量采购。
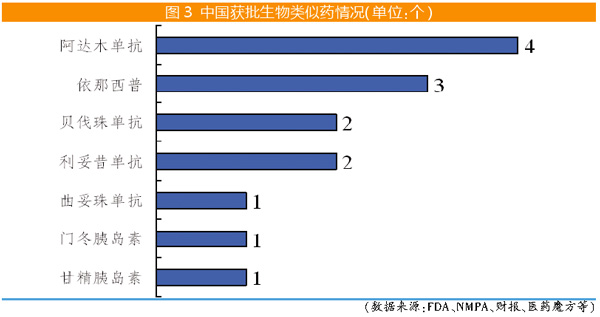
2019年2月,国家药品监督管理局(NMPA)批准复宏汉霖研制的汉利康(利妥昔单抗注射液)上市,用于非霍奇金淋巴瘤的治疗,为中国上市的首个生物类似药。据不完全统计,截至2020年底,NMPA已批准上市14个生物类似药,涉及7个参比生物药。
阿达木单抗生物类似药数量居首
艾伯维开发的修美乐(阿达木单抗注射液)是全球首个全人源抗肿瘤坏死因子ɑ(TNF-ɑ)单克隆抗体,2002年经FDA批准上市。
修美乐的专利2016-2018年在美国、中国及欧洲期限届满失效,其生物类似药也陆续上市。截至2020年底,在欧盟、美国和中国市场,阿达木单抗生物类似药获批数量均位居各地区生物类似药获批数量榜首。
鉴于阿达木单抗多适应症的陆续成功上市,CDE发布的《生物类似药相似性评价和适应症外推技术指导原则》以阿达木单抗为例进行了详细分析。随着阿达木单抗及其生物类似药在国内外的成熟应用,其生物类似药将成为未来带量采购的重点关注对象。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






