14款抗体排队上市
发布时间:2021-03-01 15:37:12作者:本报特约撰稿 李勇来源:医药经济报
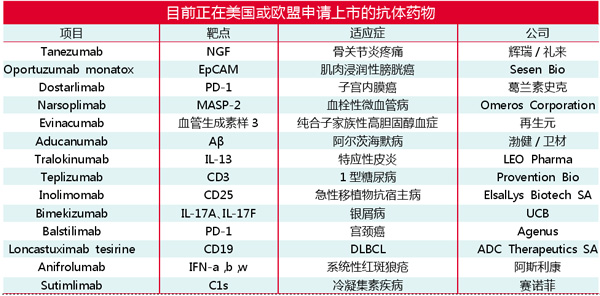
目前已有14款抗体药物在美国或欧盟提交了上市申请,正在接受FDA或EMA的监管审查,这些抗体药物有望在2021年获批上市。
Tanezumab(辉瑞/礼来)
Tanezumab是一种抗神经生长因子(NGF)人源化IgG2k抗体,正在进行治疗骨关节炎(OA)疼痛和慢性腰背痛研究,FDA已授予这些适应症“快速通道”称号,目前开发者已向FDA提交了Tanezumab治疗骨关节炎中重度疼痛的生物制品许可申请(BLA),EMA也正在对该药物的上市许可申请(MAA)进行审评。
Evinacumab(再生元)
Evinacumab(REGN1500)是一种靶向于血管生成素样3(ANGPTL3)的人IgG4k抗体,可调节血浆脂质的代谢,包括低密度脂蛋白胆固醇、高密度脂蛋白胆固醇和甘油三酸酯。Evinacumab作为纯合子家族性高胆固醇血症(HoFH)患者其他降脂治疗的辅助疗法在美国进行BLA,并获得了优先审查。FDA此前已授予Evinacumab用于HoFH的突破性疗法和孤儿药称号。
Aducanumab(渤健/卫材)
Aducanumab(BIIB037)是一种抗淀粉样蛋白(Aβ)人IgG1k抗体,目前作为早期阿尔茨海默病治疗方法正在美国进行监管审查。渤健于2007年从Neurimmune Holding AG获得了Aducanumab的许可,并且自2017年以来一直与卫材合作进行该项目的全球开发和商业化。FDA已授予Aducanumab“快速通道”称号,将在2021年6月7日对该申请作出决定。EMA也已确认受理阿尔茨海默病试验性治疗药物Aducanumab的MAA。
Tralokinumab(LEO Pharma)
Tralokinumab是靶向IL-13的人IgG4λ抗体,IL-13是与特应性皮炎和其他炎性疾病相关的多效性T辅助2型细胞因子。该抗体最初由剑桥抗体技术公司确定,由MedImmune开发为CAT-354,阿斯利康于2016年把该抗体的皮肤病学适应症权利许可给了LEO Pharma。在美国和欧盟,Tralokinumab治疗特应性皮炎适应症正在接受审查,预计FDA将于2021年第二季度针对该药物BLA作出决定。
Narsoplimab(Omeros Corporation)
Narsoplimab(OMS721)是一种靶向甘露聚糖结合的凝集素相关丝氨酸蛋白酶2(MASP-2)人IgG4λ抗体,MASP-2是补体激活的凝集素途径的效应酶。Narsoplimab用于造血干细胞移植(HSCT)相关的血栓性微血管病(TMA)适应症正在接受FDA审查。FDA授予Narsoplimab用于HSCT-TMA突破性疗法和孤儿药的称号,在欧盟也授予其HSCT适应症的孤儿药称号。Omeros Corporation于2019年10月向FDA启动了针对此适应症的滚动BLA提交,并于2020年11月完成了提交。该公司还计划向EMA提交MAA。
Teplizumab(Provention Bio)
Teplizumab(PRV-031)是一种人源化IgG1k,可与成熟T淋巴细胞上表达的CD3-ε链的表位结合,从而调节1型糖尿病(T1D)和其他自身免疫性疾病的病理免疫应答。
Teplizumab已被FDA授予预防或延迟临床T1D突破性疗法称号,EMA授予Teplizumab预防或延迟患有该病风险的优先药物资格(PRIME)称号。Provention Bio已经于2021年1月向FDA递交了Teplizumab的BLA,用于延迟或预防高危个体的临床T1D,并授予优先审评资格,预计2021年7月2日作出决定。
Inolimomab(ElsalLys Biotech SA)
Inolimomab(LEUKOTAC)是可阻断IL-2受体α链(CD25)的鼠IgG1k mAb。该药物作为类固醇难治性急性移植物抗宿主病(SR-aGvHD)Ⅱ-Ⅳ级成年患者的疗法正在美国接受监管审查。在美国和欧盟,Inolimomab被授予GvHD孤儿药称号。Elsalys Biotech于2017年从Jazz Pharmaceuticals获得了Inolimomab的开发和商业化权利,后者通过收购EUSA Pharma获得该药物。
Bimekizumab(UCB)
Bimekizumab(UCB4940)是可选择性抑制细胞因子IL-17家族的六个结构相似成员中的两个(IL-17A和IL-17F)人源化IgG1k抗体。在美国和欧盟,Bimekizumab治疗银屑病适应症正在接受监管审查。
Oportuzumab monatox(Sesen Bio)
Oportuzumab monatox(Vicineum,VB4-845)是一种由靶向上皮细胞粘附分子(EpCAM)的人源化单链抗体可变片段组成免疫毒素。目前正在评估其作为高风险非单抗的治疗方法对卡介苗(BCG)治疗无反应的肌肉浸润性膀胱癌(NMIBC)效果。2018年,FDA授予Oportuzumab monatox用于NMIBO的快速通道指定,2019年12月,Sesen Bio启动了一项滚动性BLA提交,并在2020年12月完成BLA提交,并有望在2021年获得FDA批准。Sesen Bio计划在2021年初向EMA提交Vicineum的MAA,并有望在2022年初在欧盟获得批准。2020年8月,Sesen Bio将Oportuzumab monatox在大中华地区商业化权利授予齐鲁药业。
Dostarlimab(葛兰素史克)
Dostarlimab(TS-042,GSK4057190A)是Anaptysbio与Tesaro合作开发的抗PD-1人源化IgG4k抗体,Tesaro于2019年被葛兰素史克收购。2020年第一季度Dostarlimab用于晚期或复发性失配修复(dMMR)子宫内膜癌的二线疗法分别向FDA和EMA提交BLA和MAA并被受理。
Balstilimab(Agenus)
Balstilimab(AGEN2034)是靶向于PD-1的人IgG4k抗体,目前已有多款靶向PD-1或其配体PD-L1的抗体获批上市用于治疗实体瘤及淋巴瘤。Agenus对Balstilimab的临床研究集中于将其作为单一疗法或与抗CTLA4 zalifrelimab(AGEN1884)联合使用来治疗宫颈癌。FDA授予Balstilimab和Balstilimab/Zalifrelimak用于治疗宫颈癌组合快速通道称号。Agenus已向FDA滚动提交Balstilimab作为治疗复发/转移性宫颈癌的单一疗法的BLA。贝达药业获得了该药物大中华地区独家许可权利。
Loncastuximab tesirine(ADC Therapeutics SA)
Loncastuximab tesirine(ADCT-042)是一种抗体药物偶联物(ADC)。FDA已授予ADCT-402用于治疗弥漫性大B细胞淋巴瘤(DLBCL)和套细胞淋巴瘤的孤儿药称号。2020年9月,ADC Therapeutics SA宣布向FDA提交Loncastuximab tesirine治疗复发性或难治性DLBCL的BLA,将在2021年5月21日作出决定。
Anifrolumab(阿斯利康)
Anifrolumab(MEDI-546)是干扰素(IFN)α受体1(IFNAR1)特异的人IgG1k抗体,与IFNAR1的亚基1结合,从而阻断了不同Ⅰ型IFN(IFN-a,IFN-b和IFN-w)。2020年第三季度,Anifrolumab用于系统性红斑狼疮(SLE)已在美国和欧盟提交上市申请,预计在2021年下半年作出监管决定。FDA已授予Anifrolumab治疗系统性红斑狼疮的“快速通道”称号。
Sutimlimab(赛诺菲)
Sutimlimab是一种人源化IgG4抗体,可靶向并抑制补体系统中的补体成分1s(C1s),从而干扰冷凝集素疾病(CAD)中C1激活的溶血发生。FDA已授予Sutimlimab治疗冷凝集素疾病的突破性疗法的称号,而FDA和EMA也将该药指定为孤儿药。FDA授予Sutimlimab用于治疗成人凝集素疾病的溶血患者的BLA优先审查。2020年11月14日,赛诺菲宣布FDA就Sutimlimab的BLA发出完整答复函。该信中未提及任何临床或安全缺陷,但FDA在对负责制造的第三方设施进行许可前检查期间发现了某些缺陷。赛诺菲正在努力解决问题,并将及时重新提交BLA,有望在2021年获批。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






