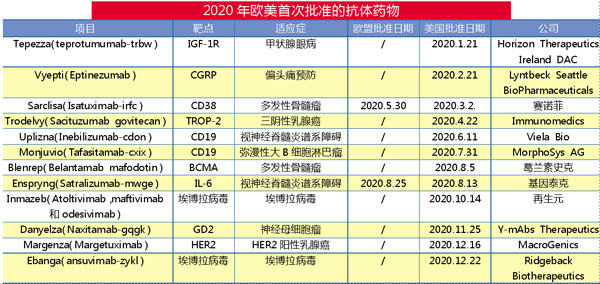
2020年欧美首次批准12款抗体
发布时间:2021-02-08 18:12:35作者:本报特约撰稿 李勇来源:医药经济报
作为近年最为热门的药物类别之一,单克隆抗体药物2020年并没有受到新冠大流行太大的影响。美国或欧盟去年首次批准了12种抗体疗法,较2019年的7款大幅增加。
Teprotumumab
2020年1月21日,FDA批准了甲状腺眼病首款疗法——Horizon Therapeutics Ireland DAC的胰岛素样生长因子1受体(IGF-1R)人IgG1k抗体Tepezza(Teprotumumab-trbw)。
Teprotumumab最初是由罗氏开发,因其同期有大量开发中的靶向同一途径分子而终止该项目开发,几经周折后被Horizon Therapeutics获得。FDA此前已授予Teprotumumab快速通道、突破性疗法和孤儿药称号。
Eptinezumab
Vyepti(Eptinezumab)是靶向降钙素基因相关肽(CGRP)兔来源的人源化、无糖基化lgG1k抗体。2020年2月21日,FDA批准该单抗用于预防成人偏头痛。
Eptinezumab由Alder BioPharmaceuticals开发,该公司于2019年10月被Lundbeck收购,并被更名为Lyntbeck Seattle。目前已有3款口服剂型和4款注射剂型CGRP类药物获批上市,未来该市场将会形成激烈竞争的格局。
Isatuximab
Sarclisa(Isatuximab-irfc)是一种靶向多发性骨髓瘤(MM)中浆细胞上过表达的CD38的嵌合IgG1k。赛诺菲的Isatuximab分别于2014和2016年被欧洲药品管理局(EMA)和FDA授予孤儿药称号。
Isatuximab于2020年3月2日首次在美国获得批准,与泊马度胺和地塞米松联合用于已接受过至少两种疗法(包括来那度胺和蛋白酶体抑制剂)的成年MM患者。欧盟委员会于2020年5月30日批准了该适应症的上市许可。
Sacituzumab govitecan
Trodelvy(Sacituzumab govitecan)是一种抗体-药物偶联物(ADC),包含与TROP-2融合的人源化IgG1k抗体,该抗体与伊立替康的活性代谢产物(SN-38)融合。2020年4月22日,FDA加速批准Trodelvy用于对接受至少两种转移性疾病治疗的转移性三阴性乳腺癌成人患者。FDA先前曾授予Sacituzumab govitecan用于转移性三阴性乳腺癌的突破性疗法和加速通道的称号,该药有望于2021年上半年在欧盟申请批准。2020年9月,吉利德与Immunomedics达成最终收购协议,以支持Trotrovy在美国的全面批准。Sacituzumab govitecan正在对激素受体阳性、人表皮生长因子受体2(HER2)阴性转移性乳腺癌、肺癌和膀胱癌进行研究。
FDA已授予Sacituzumab govitecan用于转移性非小细胞肺癌(NSCLC)、转移性SCLC和转移性尿路上皮癌快速通道称号,还被FDA指定为SCLC适应症的孤儿药,并被FDA和EMA指定为胰腺癌适应症的孤儿药。
Inebilizumab
Uplizna(Inebilizumab-cdon)是一种人源化抗CD19 1gG1k抗体,可用于治疗视神经脊髓炎谱系障碍(NMOSD)。Viela Bio的Inebilizumab被FDA授予治疗NMOSD的突破性疗法称号,并被FDA和EMA授予孤儿药称号。
2020年6月11日,Uplizna 获得FDA批准,成为在美国获批用于NMOSD的第二种抗体治疗药物。FDA于2019年6月批准了Soliris(Eculizumab)用于抗aquaporin-4(AQP4)抗体阳性的NMOSD成年患者的治疗。
Tafasitamab
Monjuvio(Tafasitamab-cxix)是一种人源化抗CD19抗体,具有工程化的Fc结构域,可通过凋亡和Fc依赖性机制起作用,包括抗体依赖性细胞介导的细胞毒性和抗体依赖性细胞吞噬作用。
MorphoSys AG的Tafasitamab被FDA和EMA授予用于治疗变应性/难治性弥漫性大B细胞淋巴瘤(DLBCL)的突破性疗法、快速通道以及孤儿药的称号。2020年7月31日,FDA加速批准Monjuvi与来那度胺联合用于不适合自体治疗的复发或难治性DLBCL成年患者。
Belantamab mafodotin
Blenrep(Belantamab mafodotin)是靶向B细胞成熟抗原(BCMA)的人源化、糖基化的lgG1k抗体,与细胞毒性剂奥斯他汀F偶联的抗体药物偶联物。FDA授予葛兰素史克的Belantamab mafodotin用于多发性骨髓瘤的孤儿药和突破性疗法称号,2020年8月5日,Blenrep获FDA加速批准用于成人多发性骨髓瘤的单药治疗,这些患者先前至少接受过4种疗法后疾病仍然进展。2020年8月25日,Blenrep获得欧盟委员会批准。
Satralizumab
Enspryng(Satralizumab-mwge)是靶向于IL-6受体的重组人源化IgG2k抗体,由日本中外制药开发,罗氏于2016年获得该项目的许可。
基因泰克的Satralizumab在美国、欧洲和日本被授予孤儿药称号。FDA于2018年12月授予NMOSD突破性疗法称号。在FDA批准之前,Enspryng已在加拿大、日本和瑞士获得批准。包括欧盟和中国在内的其他监管机构正在审评。2020年8月13日,FDA批准了Enspryng用于治疗抗aquaporin-4(AQP4)抗体阳性的NMOSD成年患者。该项目已成为过去2年获批的第三款NMOSD抗体药物。
Atoltivimab+maftivimab+odesivimab
Inmazeb(Atoltivimab、maftivimab和odesivimab)是由再生元开发的三种抗体混合物。该lgG1抗体能够结合埃博拉病毒表面的糖蛋白,从而阻止病毒粘附和进入细胞。2020年10月14日,FDA批准该药用于治疗Zaire埃博拉病毒引起的成人和儿科患者感染。
Naxitamab
Danyelza(Naxitamab-gqgk)是人源化的抗GD2 IgG1k抗体,由Memorial Sloan Kettering癌症中心开发,Y-mAbs Therapeutics获得该项目的许可。FDA授予Naxitamab用于治疗成神经细胞瘤患者的突破性疗法和罕见儿科药物称号,Naxitamab在欧盟和美国还被授予孤儿药称号。
2020年11月25日,Y-mAbs宣布FDA批准Danyelza与粒细胞-巨噬细胞集落刺激因子(GM-CSF)联合使用,用于治疗对既往治疗表现出部分缓解、轻微缓解或疾病稳定的复发/难治性高危神经母细胞瘤儿童(1岁及以上)和成人患者。
Margetuximab
2020年12月16日,FDA批准Margenza(Margetuximab)与化学疗法联合,用于治疗先前已接受两种或更多种抗HER2方案的转移性HER2阳性乳腺癌成年患者。研究显示,与曲妥珠单抗联合化疗相比,Margetuximab联合化疗可使疾病进展或死亡风险降低24%。Margetuximab是嵌合的抗HER2 IgGlk抗体,在曲妥珠单抗基础上进行了工程化改造,可以更好地实现抗体依赖的细胞介导的细胞毒作用(ADCC)效应。
Ansuvimab
2020年12月22日,FDA批准了另一款由美国国立卫生研究院(NIH)的科学家及其合作伙伴Ridgeback Biotherapeutics公司开发的靶向埃博拉病毒受体结合域的人IgG1单克隆抗体Ebanga(ansuvimab-zykl)上市。
除美国或欧盟外,2020年在其他监管机构也有抗体疗法首次获得批准,如PD-1抑制剂Forteca(Prolgolimab)和类风湿关节炎单抗Artlegia(Olokizumab)在俄罗斯获得了首次批准,全球首款光免疫疗法药物Akalux(Cetuximab saratolacan sodium)在日本获批上市。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






