欧洲市场为何只有11种细胞/基因疗法?
发布时间:2020-12-09 16:48:42作者:综合编译/廖联明来源:医药经济报
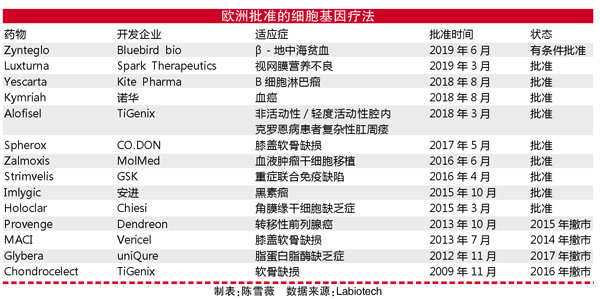
细胞与基因疗法是医药行业的大热门,为何上市的产品十分有限?据Labiotech报道,近十年只有15种先进治疗药物(ATMP)——细胞或基因疗法,在欧洲获批上市。其中已有4个药物撤市,只有其余11个药物仍在售。
要求高 研发耗时
与之形成鲜明对比的是,自2009年以来,欧盟已有500多个研究ATMP的临床试验。不过,要取得预期的结果还为时过早,其中许多都是创新技术,即使几十年前就发现的技术现在才刚进入相关领域的运用。例如,2016年批准的Strimvelis,研发历时20多年;Chondrocelect于2009年获批,从其研发公司TiGenix成立开始计算历时9年;Holoclar研发者之一的Graziella Pellegrini称,该产品的开发时间总计为25年。
即使研发时间长度没有那么令人生畏,研发资金的消耗也会快得难以承受。投资总额中很大一部分用于获得符合药监部门设定的质量、安全性和疗效标准的数据。这一过程几乎代表了开发人员面临的最大挑战之一。
事实上,在欧洲首次发布关于ATMP的政策时,欧洲药监部门和研发人员似乎处在不同的立场上。Pellegrini表示:“2007年,欧盟出台了关于先进疗法的新规定,增加了对药物研发过程中的更多要求、更漫长的耗时,这意味着研究人员必须从头开始研究。”
由于业内的频繁磋商,这些要求正在不断的简化。欧洲药品管理局(EMA)的目的是促进新药研发,让更多患者获得药物治疗。但即使有动态的监管,某些产品也可能只在个别国家获得上市批准,而不能在整个欧洲大陆范围内销售。
例如,有一条专门的审评通道可将ATMP仅在当地作为医院技术项目进行特殊批准和商业化。这种特殊批准包括几个限制:此指定用途仅适用于非常规产品,并且是针对个别患者定制的产品,进出口这些产品都是非法的。
商业化存挑战
细胞或基因疗法进入市场要经过很多复杂的程序,但费力的研发工作还没有结束。如果存在安全问题或5年后公司没有申请再注册,EMA仍可以撤销产品的生产批件。
Glybera就是一个例子,该药是首个在欧洲获批的基因疗法。由于在欧洲的销售失败以及难以进入美国市场,Glybera的开发商决定不申请再注册。由于Glybera的市场目标人群非常小,而且价格高达100万欧元(在2012年是全球最昂贵的药物),因此很难说服政府和保险公司为其报销费用。
事实上,Glybera获批上市后,仅有一个病人接受了治疗。处方这个药的医生ElisElizabeth Steinhagen-Thiessen与德国相关部门和保险公司进行了漫长的拉锯战,要求报销相应的治疗费用。
细胞和基因疗法面临的一大挑战是,其通常靶向的是极少数人患上的疾病。以Strimvelis为例,该药用于治疗重症联合免疫缺陷(ADA-SCID)。这是一种罕见的遗传免疫缺陷,在欧洲每年只有约14人、在美国每年只有12人确诊。对于Holoclar来说,目标患者数量会稍高一些。该药用于治疗角膜缘干细胞缺乏症,在欧洲,每年约有1000人属于目标患者。尽管如此,Holoclar还远谈不上是一个“重磅炸弹”药物。
事实上也有例外,例如Imlygic,这是一款安进(Amgen)于2015年获批用于晚期黑色素瘤治疗的产品。在欧盟,每年有超过5.6万例晚期黑色素瘤新增患者。
总体来看,大部分产品撤市是出于商业原因而非安全问题,这表示获得EMA批准并不意味产品能在商业上取得成功。
不过,业界可以从之前的产品失败和成功事例中吸取很多教训。随着监管机构和保险公司越来越熟悉细胞和基因疗法,研发人员避免了过去他人犯的错误,可以预见的是,未来细胞和基因疗法将变得司空见惯,不再是遥遥无期的希望。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






