罕见病不窘
发布时间:2020-11-19 12:28:16作者:张方 李柯欣(沈阳药科大学工商管理学院)来源:医药经济报
罕见病不窘
我国在罕见病探索和目录制定上已有良好开端,国外现行目录有何特点?
对我国罕见病目录修订有何启示?
《“健康中国2030”规划纲要》明确提出“完善罕见病用药保障政策”,通过完善医疗保障制度使罕见病患者能够得到治疗。目前,缺医少药仍是罕见病患者的一大困境,更是保障罕见病患者的平等健康权的难点。近几年,我国各相关部门在促进罕见病事业发展与孤儿药获得上作出了许多努力,推出一系列罕见病利好政策,切实提高罕见病患者的权益保障。不过,由于罕见病的诊疗现状、疾病种类、患病人数等基本数据不完善,给罕见病诊治、研究、医保政策制定等工作的推进带来了阻力。在第三届进博会期间,赛诺菲、武田制药、辉瑞、勃林格殷格翰多家海外制药巨头均表示了对罕见病业务板块的重视,携多款新药亮相,以解决中国罕见病患者面临的重大挑战,全力支持“健康中国2030”目标的实现。
对于罕见病的定义,主要基于两点:首先是受某疾病影响的患者人数;其次是某疾病的严重程度和是否存在适当的治疗方法。例如,美国FDA将罕见病定义为影响不到20万患者的疾病;欧洲药物管理局(EMA)则将罕见病定义为患病率低于5/10000,导致人体衰弱或者严重威胁人生病的疾病。可见,某种疾病是否被定义成罕见病,主要取决了该国的人口规模。这也就解释了为什么在不同的国家以至于在不同的年代,罕见病的定义是有区别的。是否能够在国际上共用一条众所周知的罕见病定义,对于孤儿药的认定、审批、跨国销售上市等是十分必要。
欧洲疾病所(EURORIS)公开了目前世界上存在6000~8000种罕见疾病。由于罕见病的发病率低,且部分疾病目前尚无有效的治疗方法,对于制药企业来说,孤儿药的市场规模小,如果在没有政策鼓励的情况下,药企投入大量成本研究开发孤儿药,因无法收回预期的投资将变得无利可图。为了避免加重孤儿药也“罕见”的窘境,近年来,各国开始纷纷出台相关立法鼓励罕见病孤儿药的认定,确定并发布国家版罕见病目录便是其中最有力的支持和导向。
各国现行目录对比
欧盟:共纳入6172种罕见病
欧盟的罕见病目录来源于ORPHANET网站(收录日期截至2020年9月),该网站于1997年在法国成立,以收集有关罕见病的知识,从而改变对罕见病患者的诊断和治疗。该网站不仅收录了罕见病目录,还收录了《欧盟孤儿药》,显示了所有有欧盟销售许可的孤儿药,包括经欧盟认定的孤儿药,以及仅在欧盟有销售许可但未获得欧盟认定的孤儿药。
根据该组织于2020年1月最新发布的《罕见病的发病率书面报告》,目前ORPHANET在其目录中统计了6172种罕见病。其中,71.9%来源于遗传,69.9%是儿童特有的。该目录提供按照首字母索引搜索疾病名称,在每种疾病后又设置延伸解释,包括该疾病的流行率、临床数据、病因、诊断、治疗和预后。
通过该目录还可以找到该疾病在PUBMED中出版的文章,以及正在做的一些研究。如果该疾病目前有适应证药物,还可以通过目录查到该药,并以此明确该孤儿药的保障等问题。该目录从欧盟实际出发,但也在全球范围内得到了多数国家的认同和使用。
美国:将罕见病分为32个类别
美国的罕见病目录来源于遗传病和罕见病信息中心(Genetic and Rare Disease Information Center,GARD),共收录7000余种罕见病,其将疾病细分自身免疫性疾病、细菌感染、行为和精神障碍疾病、血液疾病等32个类别。
同样,GARD也提供按照疾病首字母检索疾病。每种疾病延伸检索可以查到该疾病的其他名称、病症、病因、诊断、治疗、临床研究以及该疾病目前FDA是否有明确适应证的孤儿药上市,且对该药物的生产商等详细介绍。值得注意的是,GARD对某种罕见病的治疗指南,提供了该疾病可能涉及的一些专科专家指南,例如神经纤维瘤Ⅰ型来源于遗传,涉及皮肤、五官、神经、肿瘤等许多病症,因此,其推荐更加科学和清晰。并且推荐了有关该疾病的机构和组织,还列出其地址和联系方式,这有利于患者寻找和自己有同样经历的患者群体并与其联系和沟通,从而获得有价值的服务。
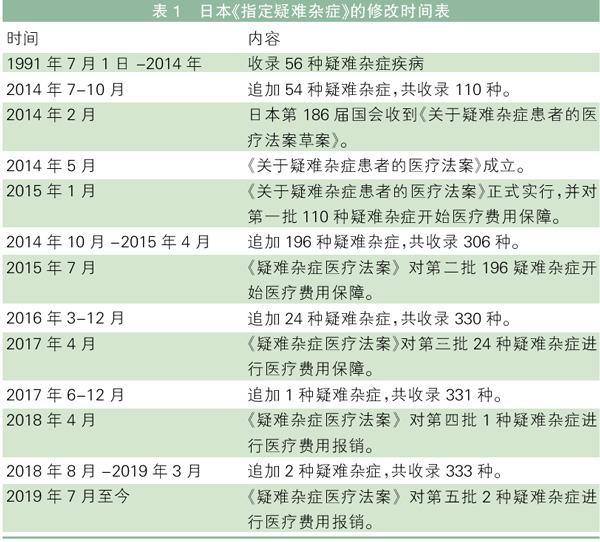
日本:历经5次追加收录333种疾病
日本的罕见病立法为《疑难杂症法》,其将罕见病定义为需要长期疗养、发病机制尚不明确、治疗方法没有确立、患者人数达不到人口的0.1%的罕见疾病。
日本的罕见病目录由厚生劳动省下属研究组以及相关学会对该疾病信息收集和整理,并公布了罕见病目录——《指定疑难杂症》。
《指定疑难杂症》中收集的罕见病,按照日本《关于疑难杂症患者的医疗法律》可以得到医疗费用保障。该目录经历过5次追加,目前共收录333种疾病(其修改情况见表1)。
该目录同样支持检索具体某罕见病的相关内容,并将疾病分为15种类别。虽然相比欧盟和美国,日本的罕见病目录在数量上收录的不多,但目录内的疾病均能够得到医疗费用保障,这比欧盟和美国做得好。
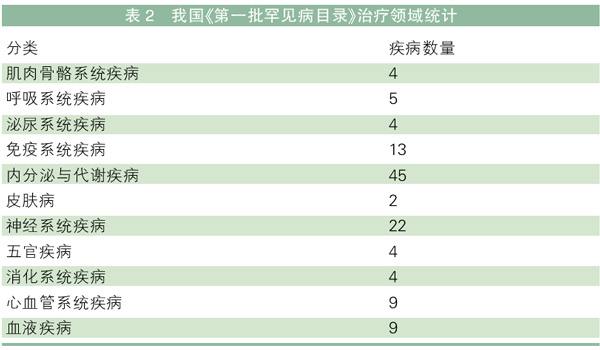
中国:第一批目录收录121种疾病
我国卫生、药监等多部门联合于2018年6月制定并发布了《第一批罕见病目录》,包含了121种罕见病,涉及肌肉骨骼系统、呼吸系统、泌尿系统、免疫系统、内分泌系统、皮肤、五官、神经系统、心血管系统和血液系统(见表2)。
虽然第一批目录仅收录了121种疾病,与我国目前出现的罕见病数量还有一定的差距,但相关部门已经开始建立动态管理平台,进而有望不断完善该目录。伴随着罕见病目录的诞生,加之多项政策出台保障对治疗罕见病的药品予以优先审评审批,势必推动医药企业对孤儿药的研究和开发,对待罕见病患者来说,更是福音。
启示
罕见病目录的公布和明确界定,无论对于哪个国家来说,都是对其罕见病研究组织的规范化管理,对疾病的诊疗水平更加明确的指导和依据。以下笔者对国外目录内容形式给我国目录修改带来的启示进行分享。
启示一:收录病种数量需待追加
虽然罕见病的发病率低,但基于我国人口基数大,罕见病患者的群体数量不可小视。我国相关部门应加快对专属于我国罕见病定义的确定。达到什么标准的疾病将录入我国罕见病目录,是基于人数还是其他限定,都应该做出明确规定。
并在该规定的基础上,做到科学公平的遴选,动态化的补充和认定,使得其他也很值得关注的罕见病能够早日纳入目录,获得医学界有关罕见病诊断治疗和孤儿药研发的支持,尽快减轻罕见病患者的负担。
启示二:罕见病网络信息平台有待建设
从上述欧盟、美国和日本相应罕见病的治理措施可以看到,每个国家和地区都建设了专职的立法、专职的部门进行管理,而我国目前尚未有明确的专门组织形成,立法方面也只是在相关法律里设立法条,并没有单独成文进行专职化立法。
上述三个国家和地区还运用了现代化的网络,建立网络信息平台,在该平台不仅可以详细的了解每种疾病的诊疗、原理等临床数据,还提供了线下的专业医疗机构提供给你服务。并且涉及孤儿药的信息平台,可以直面了解到某罕见病是否有合适的药物,从而对该病有初步的了解。此外,平台还提供由某罕见病患者集聚建立的社会福利组织,增加患者对患者的帮助。这些快捷的网络渠道我国仍有待建立,且十分必要。
启示三:继续完善孤儿药的开发和审批
由于罕见病的特殊性,对于医药企业来说,市场规模小,研究开发孤儿药可能由于无法收回预期的投资,许多企业对孤儿药的研究望而却步,造成了罕见病可使用、可选择的孤儿药少之又少。
据统计,《第一批罕见病目录》公布的121种罕见病中,需要药物治疗的疾病共有98种。因为某些罕见病目前尚未有明确且有效的治疗药物,只能对症用药。形势的严峻不仅如此,虽然有98种疾病拥有治疗药物,但是这些药物并非都已在我国上市。统计显示,对比国外孤儿药的上市信息,在《第一批罕见病目录》中的121种罕见病,有36种疾病拥有美国FDA批准的孤儿药60种,其中在我国上市的为27种,占比45%;18种疾病拥有EMA批准孤儿药27种,其中我国上市的仅有8种,占比29.63%。这表明我国孤儿药上市使用还存在很大缺口。所以,主管部门等可进一步提出激励措施,鼓励国内医药企业进行孤儿药开发研究,并提高孤儿药的审批速度,提高医学临床试验技术,使得患者能够得到更多可以使用的孤儿药。
启示四:完善罕见病保障机制
根据IQVIA发布的《罕见病行业报告2019》,罕见病领域目前存在三大挑战:孤儿药的可及性、高值药物医保空白和不同地区的差异。建议建立一种全国罕见病医疗保健机制,其中对于孤儿药的偿付,用有限的资金做到有效的支付,做到一种创新的支付方式——以质量支付效果,即加强对疗效的考量。
由于存在患者个体差异,基于个体水平,站在患者的角度,如果某种药物对患者有50%的疗效改善,那么,支付50%的这种情况是值得进一步研究的。政策相关制定者可以吸取部分有独立对罕见病的医疗保障探索的省份做法,例如青岛市关于戈谢病对罕见病的保障多方支付的可行性,以及江苏省卫生部门还增加政策性商业保险等做法来探索罕见病的保障的新模式。因此,在全国是否可以推行一种全新的保障方式,将罕见病的保障区别于普通疾病是值得完善和研究的。
我国对于罕见病的探索以及目录的制定还在初步阶段,但已经有了很好的开端,相信未来我国会依次在目录完善、孤儿药开发和审批,以及对罕见病的保障上做出更好的补充。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






