医械行业走向5大预判
发布时间:2020-11-11 16:34:18作者:特约撰稿 李丹荣来源:医药经济报
医械行业走向5大预判
从前三季度数据统计来看,疫情推动了国内疫情用医疗器械审批加速,医用口罩、体外诊断试剂、体温检测设备、医用防护服等抗疫类医疗器械注册数量迅猛增长,体现了医疗器械在现代医疗尤其是应急医疗中所占据的重要地位。接下来,医械行业有以下几个发展趋势:
【预判1】
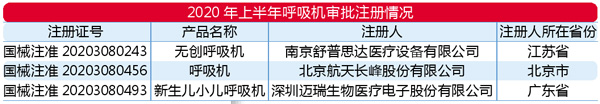
抗疫类如呼吸机和高端检测试剂盒
加速发展
国家卫健委等3部门发布的《公共卫生防控救治能力建设方案》中提到,要强化生物安全意识,确保医疗机构储备质量合格、数量充足的医用口罩、隔离衣、眼罩等防护用品,一般不少于10日用量,以满足公共卫生特别是重大疫情防控救治的需求。
从进口数据来看,高端呼吸机进口需求较大,国产呼吸机存在需求供给不足的矛盾,这就促使各相关企业积极研发创新,掌握关键技术,确保在短时间内形成供应保障能力。
比如,在中国市场,新冠肺炎疫情中被视为重症患者救命“终极武器”的ECMO细分领域主要被迈柯唯(Maquet)、美敦力(Medtronic)、索林(Sorin)/理诺珐(LivaNova)、泰尔茂(Terumo)、米道斯(Medos)等国际品牌瓜分。我国目前仍无法生产ECOM设备,这一问题在疫情期间已经引起了监管部门和医药产业的高度关注。产业链值得花大力气去研发和生产自主品牌产品,科技部已经启动了攻关项目。
在新冠病毒核酸检测领域,国内产业将进一步在提高检测速度和检测准确性方面加强研究,继续领先国际。根据最新报道,清华团队研发一体化自助式SARS-CoV-2核酸检测卡盒(BINAS),30分钟内即可实现“样本入、结果出”。部分体外诊断企业加快了微流控技术的应用研发,将大大提高检测的灵敏度和准确性。
【预判2】
高端医疗器械
加速发展+鼓励进口替代
前不久,工业和信息化部批复组建国家高性能医疗器械创新中心。国家高性能医疗器械创新中心依托深圳高性能医疗器械国家研究院有限公司组建,股东包括迈瑞生物、联影医疗、先健科技、中科院深圳先进技术研究院、哈尔滨工业大学等行业骨干单位。创新中心将围绕预防、诊断、治疗、康复等领域的高性能医疗器械需求,聚焦高端医学影像、体外诊断和生命体征监测、先进治疗、植介入器械、康复与健康信息等重点方向,着力打通原理和技术、关键材料、关键器件、系统和产品等研发和产业化链条,扎实推进医疗器械领域创新体系建设,提升我国高端医疗设备生产制造和整体产业水平。
按照国务院治理高值医用耗材改革方案以及医疗器械审评审批制度改革要求,加大对国产类高值医用耗材在研发、注册、流通、招标、采购、使用等环节的支持力度,进一步调整和优化产业结构。同时,以推进医疗器械唯一标识工作为契机,加快建立并实施医疗器械追溯制度,探索实施高值医用耗材注册、采购、使用等环节医疗器械唯一标识编码的衔接应用,建立高值医用耗材数据库,加强数据的共建共享和挖掘分析,为治理高值医用耗材改革提供数据支撑。
【预判3】
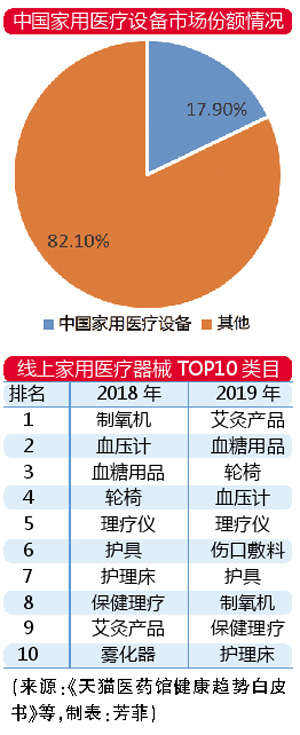
网售家用器械显活力
疫情的爆发唤起了社会大众对健康生活方式的重视。疫情期间,全民居家隔离,学会自我监测健康状况成为了基本的防护步骤,因此家用医疗器械成为必不可少的“装备”。
而互联网医疗在疫情下优势凸显。互联网医疗企业不受地域场景限制的优势,充分展现了其在医疗体系中基础问诊和分诊的重要效用。即便在医疗系统发达的美国,COVID-19的突发事件下也暴露出供应不足的巨大压力问题。我国互联网医疗企业诸如平安好医生、阿里健康、微医、春雨医生、微脉等平台都已逐渐跑出其商业模式。随着新冠疫情的发展,监管对互联网诊疗的开放性日益增高,因此,持续看好已有大流量变现基础的平台,值得关注的是,平安好医生、阿里健康股价也在疫情期间接近翻倍。
【预判4】
营商环境进一步优化,注册审评审批提速
长期以来,中国医疗器械企业缺乏自主创新意识,产品在研发质量、性能品质、设计工艺等方面全方位落后于外资企业。因此在推进产业发展、实现医疗器械国产化过程中,中国政府不仅需要面对核心技术薄弱、关键材料缺乏的基础现状,从源头上解决医疗器械国产化的问题,还要进一步从监管体制、政策制定等多方面进行产业扶持。
具体来看,聚焦“六稳六保”;国家鼓励医疗器械产业高质量发展政策;商事制度改革;营商环境改革;适应高质量发展要求的新型市场监管机制逐步构建的大背景下,医疗器械行业发展面临前所未有的发展机遇。
加速审评审批方面,此前国家药监局发布《关于调整医疗器械临床试验审批程序的公告》,简化医疗器械审评审批流程。河北、湖北、天津、苏州等省(市)也出台相应政策,通过优化审评审批流程、开通绿色通道等方式,缩短产品上市时间。据统计,创新优先后的平均审评审批时间较其他普通三类首次注册产品平均压缩83天,大幅压减创新医疗器械审评审批时间。在促进创新成果转移转化方面,河北、天津、苏州等省(市)加大对创新产品研发的资助力度,通过多种投资方式,支持创新成果转化;对创新产品进入医保、集采、推广等方面给予支持,实施优先政策,提供全程化服务。
根据国家药监局发布《关于扩大医疗器械注册人制度试点工作的通知》,在上海、广东、天津自贸区开展医疗器械注册人制度试点工作的基础上,明确将医疗器械注册人制度试点扩大到北京、天津、河北等21个省(区、市),为医疗器械注册人制度全面实施积累经验。此后,北京、天津、重庆等多地发布实施方案,加速推进医疗器械注册人试点工作。截至2019年12月,21个试点省(区、市)医疗器械注册人制度试点工作实施方案已全部出台,于2020年进入实施期。医疗器械注册人制度试点打破注册与生产两大环节的“捆绑”模式,将极大激发医疗器械研发机构的创新活力,促进创新产品快速上市。系列措施均为企业创新提供有利保障,未来企业创新将加速。
通过审批制度、流通环节等多个重点环节的政策支持,中国医疗器械行业创新研发能力不断提升,关键技术领域不断取得突破,部分细分领域已逐步实现进口替代,尤其是中国先进的医疗器械重点产品发展实现较大突破,产业整体正朝着品牌化、高端化方向发展。未来,在政策环境不断改善的背景下,中国医疗器械产业有望继续保持快速发展,国产医疗器械研发创新、市场应用与覆盖等多方面有望实现进一步提升。
另值得一提的是,营商环境进一步优化、商事制度改革深化,也将有力促进医疗器械产业创新发展,市场主体活力进一步迸发。
根据《中国省份营商环境评价:指标体系与量化分析》研究,北京以78.23分摘得“营商环境第一省份”,上海、广东紧随其后,分列第二、第三,海南营商环境排名第12。同时从区域经济带看,“21世纪海上丝绸之路”圈定上海、福建、广东、浙江、海南5省市,这5个省市的营商环境均值远高于全国总体均值,市场环境“子环境”的排名均靠前且差异相对较小,“对外开放”指数均值远高于全国均值。
政策加持以及更优的营商环境,正不断为各地高质量发展医械产业孕育新动能,构筑新优势。
【预判5】
医械进口将持续减弱
国家药监局公开数据统计显示,尽管呼吸机产品进口需求较大,2020年上半年进口医疗器械通过审批注册备案较去年同期下降75%,充分反映出在新冠疫情影响下,进口医疗器械数量严重下降。
与此同时,随着中美贸易问题等大国关系的变化,中国医械企业在2020年面临的不确定性会进一步加剧。最显著的特征是:国外在高端技术领域的封锁预计不会降低,高端技术和产品面临的竞争和市场间的博弈会进一步增强。
预计下半年医械进口仍将持续减弱,疫情之后全球供应链将重构,企业应充分认识到其中的机遇与挑战。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






