哪些疫苗是潜在“重磅炸弹”
发布时间:2020-11-11 15:45:34作者:李勇来源:医药经济报
哪些疫苗是潜在“重磅炸弹”
随着新冠大流行在全球蔓延,疫苗突然成为今年的热点。虽然目前全球几乎都把目光放在COVID-19候选疫苗身上,但生物制药公司并未放弃其他有前途的疫苗项目。
肺炎疫苗:默沙东能否挑战辉瑞?
在肺炎疫苗领域,目前辉瑞处于绝对统治地位。随着默沙东的加入,未来或将两强对垒。
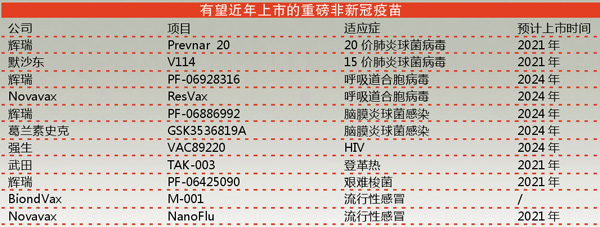
1.Prevnar 20/辉瑞
肺炎球菌疫苗Prevnar 13一直是辉瑞的重磅产品,去年该疫苗为辉瑞带来了58.5亿美元的收入,是全球最畅销的疫苗。
然而,辉瑞并不满足于此。该公司正在开发20株肺炎球菌结合疫苗Prevnar 20,并在今年3月公布了Ⅲ期临床试验结果,结果表明该疫苗在60岁以上成人20种血清型中有19种达到了免疫原性目标,包括Prevnar 13涵盖的所有血清型。在18~59岁的成年人中,该疫苗在所有20种血清型中均达到目标。
此前,辉瑞公布的Ⅱ期数据显示,Prevnar 20具有与Prevnar 13相似的安全性,并对婴儿产生了针对所有20种血清型的免疫反应。该公司今年5月开始在儿童中进行关键的Ⅲ期试验,该试验可能会持续到2022年。
预计Prevnar 20将于今年晚些时候向FDA提交上市申请,以期2021年中期能够获得FDA批准。
2.V114/默沙东
默沙东无疑是辉瑞未来在肺炎球菌疫苗领域最具实力的竞争者。
默沙东9月发布15价疫苗V114关键的Ⅲ期数据后,也计划与辉瑞同步争取年底前提交上市申请文件。研究数据显示,V114的效力与Prevnar 13相当,甚至在三种关键血清型上都优于后者。V114比Prevnar 13增加了两种血清型(22F和33F)。
在针对婴儿人群方面,默沙东的研究也领先于辉瑞:2019年1月,默沙东的疫苗针对6周至18岁患者获得了FDA突破性疗法称号。而辉瑞于当年9月发布了针对婴儿的Ⅲ期数据。
如果获批上市,V114将与辉瑞的Prevnar 20直接竞争Prevnar 13的58.5亿美元市场。
RSV疫苗:着眼未来
呼吸道合胞病毒(RSV)疫苗未来将跃居第二位。GlobalData分析师预计,到2028年,RSV疫苗的销售额将达到50亿美元。
1.PF-06928316/辉瑞
辉瑞的RSV候选疫苗RSVpreF(PF-06928316)处于领先地位。RSVpreF可通过在孕期给母亲接种疫苗来保护婴儿免受RSV感染。
辉瑞6月启动了关键性Ⅲ期试验,预计该研究要到2023年8月才能完成,将于2024年获得批准。2018年11月,FDA授予RSVpreF快速通道资格(FTD)。
葛兰素史克、强生和巴伐利亚北欧公司也都具有进入Ⅱ期的RSV疫苗候选物。赛诺菲和阿斯利康合作开发的单克隆抗体nirsevimab也已进入Ⅲ期,该抗体旨在预防RSV引起的下呼吸道感染。
2.ResVax/Novavax
最近,业界对Novavax公司的关注主要因为其COVID-19疫苗工作,多年来该公司一直在推进其RSV和流感疫苗项目。
在RSV疫苗领域,Novavax开发的ResVax是一种以磷酸铝为佐剂的RSV融合(F)蛋白重组纳米颗粒疫苗。2016年,该疫苗针对老年人的Ⅲ期试验失败后,该公司股票遭受了惨重损失。
ResVax对RSV和社区获得性下呼吸道感染(LRTI)住院治疗的有效性为44%,对严重低氧血症的有效性为48%,但这些数据并不意味着该疫苗完全没有希望。Novavax仍认为可以设计新的临床试验对ResVax进一步开发。
脑膜炎疫苗:谁跑得更快?
去年,葛兰素史克在脑膜炎疫苗获得了约10亿英镑(13亿美元)的收入,超过了辉瑞在该领域的3.65亿美元。如今两家公司在脑膜炎新疫苗上又开始了竞争。
1.PF-06886992/辉瑞
在新一代脑膜炎疫苗的竞赛中,辉瑞和葛兰素史克是最主要的竞争者。两家公司最近都开始了其候选疫苗的Ⅲ期试验,并希望在2022年完成试验。
辉瑞正在进行其候选疫苗PF-06886992(Men ACWY结合Nimenrix并与Men B疫苗Trumenba混合组成的疫苗)与公司现有的脑膜炎球菌疫苗进行对比试验。辉瑞于今年6月开始进行Ⅲ期试验,招募了约2400名参与者,其中包括曾接种过和未接种过脑膜炎疫苗的参与者。计划于2022年4月之前完成研究。
去年,辉瑞公司的Nimenrix在全球创造了2.3亿美元的收入,较前一年增长65%。Trumenba收入1.35亿美元,增长16%。与此同时,葛兰素史克的脑膜炎疫苗全年产生了约10亿英镑(13亿美元)的收入。
辉瑞的目标是在2023年上半年提交计划,预计在2024年获得批准。
2.GSK3536819A/葛兰素史克
辉瑞的组合Men ABCWY疫苗进入Ⅲ期试验仅两个月,葛兰素史克就对GSK3536819A更大规模试验计划采取了后续行动。
5合1组合脑膜炎疫苗GSK3536819A分别针对Men B和A、C型、Y型和W-135型,建立在脑膜炎疫苗Bexsero和Menveo的经验之上,是辉瑞公司2015年通过大规模资产交换中收购的前诺华的疫苗。
葛兰素史克今年8月份开始进行GSK3536819A的Ⅲ期试验,计划在美国、加拿大、欧洲、土耳其和澳大利亚招募3650名10~25岁的参与者,并计划在2022年9月结束该试验。相比之下,辉瑞的Men ABCWY计划在2022年4月完成Ⅲ期临床试验。
流感疫苗:传统领域也有新竞争者
在传统的流感疫苗领域,如今迎来新面孔。
1.M-001/BiondVax
BiondVax公司花费数年时间开发和试验其潜在的通用流感疫苗M-001,2018年开始在东欧进行大规模的Ⅲ期研究后,目前几乎准备报告疗效结果。在这项研究中,两个流感季节期间,该公司在7个国家的12000多名50岁以上的成年人中试验了其候选疫苗。如果结果令人满意,BiondVax计划在欧洲和美国寻求批准。
M-001由9种常见的肽组成,是流感病毒株的“共同指标”。该疫苗不会诱导免疫系统产生抗体,而是诱导细胞免疫。
与现有技术相比,该公司的疫苗具有多个潜在优势。M-001可以全年生产和管理,从而有机会摆脱每年在每个流感季节之前生产和管理疫苗的高峰。M-001的保质期也比传统流感疫苗更长。候选疫苗可以在冰箱中保存两年以上,而且在室温下可以稳定放置六个月。
2.NanoFlu/Novavax
Novavax基于细胞的重组流感疫苗候选产品NanoFlu将公司的Matrix-M佐剂平台与重组纳米粒子技术相结合,可以展示不受表面变化病毒保守抗原区域的影响,从而提供针对多种菌株的广泛保护。
2019年1月发布的Ⅱ期数据中,与Sanofi Pasteur许可的Fluzone高剂量相比,NanoFlu在60岁以上的成年人中针对多种流感毒株(尤其是H3N2毒株)产生了明显更高的抗体反应。
今年3月,NanoFlu在对2652名65岁以上的成年人进行的Ⅲ期研究中达到了所有主要和次要终点。该产品有望在今年年底前提交FDA,可能获得FDA加速批准。
除了BiondVax、Novavax之外,Imutex公司还在寻求通用流感疫苗,在获得2b期阳性数据后,寻求与Big Pharma建立伙伴关系以推进该项目。其他几家公司也进入了更具保护性的流感疫苗领域,包括拥有通用候选产品的FluGe n公司和已有流感疫苗的上市公司Seqirus、赛诺菲和强生。
其他疫苗:潜伏重磅产品
1.HIV疫苗:VAC89220/强生
多年来,HIV疫苗研究领域屡屡遭遇挫折。今年2月,由葛兰素史克和赛诺菲合作开发的疫苗HVTN 702(Uhambo)在Ⅲ期遭遇失败。这项为期5年,约5400名参与者的研究是由2009年在泰国完成临床试验的艾滋病疫苗改进而来,针对南部非洲流行的艾滋病病毒亚型进行了适应性改变,有效性仅为31%。然而这并没有阻止生物医药行业对HIV疫苗研发的信心。
强生正在开发一种名为Ad26.Mos4.HIV的候选疫苗,该款疫苗含有利用多种HIV-1亚型基因的免疫原,目的是提供一种可用于全球任何地方的“全球性”疫苗。
2017年,在观察到Ad26.Mos4.HIV积极的早期数据后,强生及其合作伙伴启动了一项名为Imbokodo的2b期研究。该研究在南部非洲的五个国家招募了2600多名年龄在18~35岁的性活跃女性,预期在2022年取得研究结果。
2019年10月,强生及其合作伙伴在北美、南美和欧洲的8个国家启动了一项Ⅲ期研究,招募3800人,预计该试验将在2023年结束。
2.登革热疫苗:TAK-003/武田
耗时20年,耗资15亿欧元,赛诺菲几年前推出世界上首款登革热疫苗,但由于安全性争议,后期的推广被迫取消。
现在,武田希望其晚期项目TAK-003能够获得好结果。
在一项名为Tides的研究中,研究人员在拉丁美洲和亚洲的登革热流行国家,针对2万名年龄在4~16岁的参与者中进行了TAK-003的安慰剂对照研究。试验中,TAK-003治疗组的人数是安慰剂组的两倍。研究人员追踪了疫苗组61例登革热病例,以及安慰剂组149例患者的试验结果,《新英格兰医学杂志》上发表的试验结果显示,接受两种剂量TAK-003的患者中,疫苗的有效率达到了80.2%。
除了Tides的研究之外,该疫苗还在进行其他4项Ⅲ期试验。武田计划在今年底公布试验24个月分析的详细信息。该公司预计明年提交上市申请。业界认为TAK-003有望成为潜在的“重磅炸弹”。
3.艰难梭菌疫苗:PF-06425090/辉瑞
辉瑞的20价肺炎球菌疫苗引起了极大关注,同时该公司也在开发艰难梭菌疫苗。如果获得批准,这将是针对该感染类型的首款疫苗。
辉瑞开发的名为PF-06425090的候选疫苗,已于2017年进入Ⅲ期试验。该疫苗的晚期研究预计将于今年年底公布。
PF-06425090通过触发针对艰难梭菌中两种导致疾病的主要毒素的抗体反应,旨在预防医疗机构中经常发生的艰难梭菌感染。业界预测该疫苗将于2021年投放市场,销售额最高将达到3亿美元,甚至达到重磅炸弹级水平。
除了辉瑞外,Valneva公司也拥有候选艰难梭菌疫苗药物VLA84,该疫苗已完成Ⅱ期研究。辉瑞正在寻找合作伙伴进行Ⅲ期试验。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






