CTLA4/PD1双抗竞赛激烈 中国公司领跑
发布时间:2020-10-26 17:11:43作者:李勇来源:医药经济报
细胞毒性T淋巴细胞抗原4(CTLA-4)作用于免疫反应的启动阶段,导致活化的T细胞减少并阻止记忆性T细胞的生成。而肿瘤细胞能够激活CTLA-4,使活化的T细胞失去活性,从而实现免疫逃逸。
然而,CTLA-4抑制剂的严重毒副作用一直是该类药物的主要缺点,如百时美施贵宝已上市的Yervoy(ipilimumab)可能导致免疫介导的重度、致死性不良事件,这类事件可能是由T细胞活化和增殖引起的。
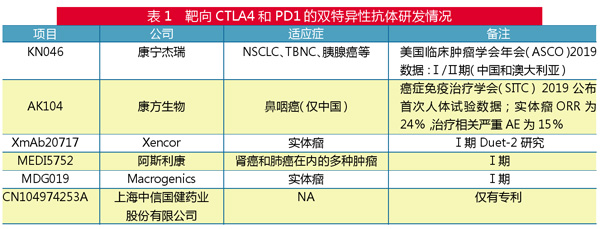
不过,靶向CTLA4和PD1的双特异性抗体被认为可以解决CTLA-4抑制剂的严重毒副作用问题。目前,CTLA4/PD1的研发竞赛可谓你追我赶。2017年9月,康方生物AK104成为全球首个进入临床试验的CTLA4/PD1双抗药;2018年4月,阿斯利康的MEDI5752在澳大利亚启动首次人体临床试验;2018年6月,康宁杰瑞KN046亦在澳大利亚开展Ⅰ期临床试验;2019年7月,康宁杰瑞KN046启动首个Ⅱ期临床,成为全球首个进入Ⅱ期临床者; 2020年4月,齐鲁制药QL1706获批开展临床试验。可以预见,未来CTLA4/PD1双抗市场赛道也将十分激烈。
阿斯利康:坚定信仰者
在业内普遍不看好CTLA-4的时候,阿斯利康仍然坚信CTLA-4抑制剂机制在多种肿瘤类型中的治疗潜力。目前准备启动双特异性抗体MEDI5752的大型Ⅱ期临床试验。
MEDI5752可同时靶向CTLA-4和程序性细胞死亡蛋白1(PD-1),并已设计为靶向表达这些免疫检查点的肿瘤患者的淋巴细胞。阿斯利康肿瘤学研发部负责人若泽·巴塞尔加(JoséBaselga)表示,早期研究表明,双特异性药物对CTLA-4的抑制作用明显更高,且毒性大大降低,进而促使该公司继续推进该药物项目。
MEDI5752于2018年4月在澳大利亚启动了首次人体临床试验。若泽·巴塞尔加表示,将迅速推进CTLA-4在各种适应症中的研发,包括肾细胞癌、黑色素瘤、肝细胞癌、肺癌,希望启动一系列非常积极的计划。”
阿斯利康对CTLA-4抑制剂的执着还反映在其开发的另一款CTLA-4抑制剂单克隆抗体Tremelimumab。目前Tremelimumab与阿斯利康首款PD-L1单抗Imfinzi(durvalumab)联合,在临床试验计划中进行了非小细胞肺癌(NSCLC)、膀胱癌、头颈癌、肝癌和血液癌的测试。但是,2017年,在治疗NSCLC的研究中显示具有严重的毒性反应。阿斯利康认为Tremelimumab药物的毒性是由于与非肿瘤相关的CTLA-4受体结合而引起的。一些临床前研究表明,与周围的淋巴细胞不同,肿瘤浸润淋巴细胞(TIL)共表达这些受体,并且这些相同的TIL可能对单个检查点阻断具有抵抗性。尽管阿斯利康对该药物开发投入巨资,但尚不清楚Tremelimumab是否最终会被推向市场。
不论如何,阿斯利康在MEDI5752的进展,至少将使其成为该领域在西方的领先开发商。
康宁杰瑞:全球领跑者
江苏康宁杰瑞自主研发的KN046是全球首款同时针对两个经过临床验证的免疫检查点PD-L1及CTLA-4的双特异性抗体(BsAb)药物。KN046在临床前和临床上显示了良好的安全性,目前在中国和澳大利亚处于Ⅰa/Ⅰb期临床试验阶段。KN046的Ⅰ期临床试验结果显示,在二期以及晚期非小细胞肺癌中,KN046的DCR(疾病控制率)和ORR(客观缓解率)分别为85.7%及28.6%。同时,KN046(作为一线疗法)联合化疗对中国三阴乳腺癌受试者进行的Ⅱ期临床试验中,ORR为66.7%。
2019年7月,江苏康宁杰瑞在中国开展了KN046一项多中心、开放、单臂的Ⅱ期临床研究,将着重研究KN046在一线非小细胞肺癌患者群体中的安全性和疗效。试验在全国范围内约10个研究中心开展,计划招募50例受试者。2019年9月6日,该公司宣布,KN046联合化疗在晚期非小细胞肺癌受试者中的安全性、有效性和耐受性Ⅱ期临床研究(研究编号:KN046-202)完成首例患者给药。KN046是目前全球范围内唯一进入Ⅱ期临床试验的PD(L)1/CTLA4候选药物。
2020年8月16日,KN046联合含铂化疗治疗IV期鳞状非小细胞肺癌进入Ⅲ期临床试验。
康方生物:首个进入临床
AK104是康方生物利用其独特的Tetrabody双抗平台自主研发的PD1/CTLA4双特异抗体,2017年9月在澳大利亚进行临床试验,也是全球首款进入临床试验的PD1/CTLA4双特异抗体。适应症方面,宫颈癌、胃癌、胃腺癌、非小细胞肺癌、肝癌等的研究处于Ⅱ期临床,晚期实体瘤研究处于Ⅰ期临床。
AK104已在澳洲完成Ⅰa期剂量爬坡临床研究;在中国已启动Ⅰb/Ⅱ期临床试验,主要评估AK104单药治疗晚期实体瘤和AK104联合标准化疗一线治疗针对不可手术切除的晚期或转移性胃腺癌或胃食管结合部腺癌患者的有效性和安全性。AK104二线或三线招募晚期宫颈癌患者正在国内进行中。
2019年4月2日,中山康方生物医药有限公司宣布,其旗下子公司康方药业有限公司的抗PD-1/CTLA-4双特异抗体新药——AK104的临床试验IND获得美国食品及药物管理局(FDA)的批准,在美国开展针对多种恶性肿瘤的临床试验。
此外,在CTLA4/PD1双抗领域,美国Xencor公司的XmAb20717治疗晚期实体瘤进入到Ⅰ期临床试验,美国Macrogenics公司的MGD019正在Ⅰ期剂量递增研究中进行评估。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






