基因疗法 临床安全隐忧
发布时间:2020-10-15 15:07:13作者:李勇来源:医药经济报
美国FDA于2017年12月19日批准了Spark Therapeutic公司的基因疗法Luxturna(voretigene neparvovec),用于治疗RPE65变异导致的视网膜营养不良。这是美国批准的第一款真正意义上的基因疗法,也是世界上第一个腺相关病毒(AAV)2递送的基因疗法。
监管机构的批准开启了基因疗法的研发和投资热潮。作为近年来国内外医药行业最为关注的热点之一,基因疗法蓬勃发展的背后,其安全性问题也逐渐凸显。
3起死亡事件
今年5月6日,基因疗法公司Audentes(去年被安斯泰来收购)AT132用于治疗X连锁肌管肌病(XLMTM)的ASPIRO试验(NCT03199469)中,一名儿童死于败血症。FDA已经介入调查,以确定是否与大剂量腺相关病毒治疗有关。不幸的是,6月23日,在同一队列中的另一名儿童,接受相同剂量的腺相关病毒,也因治疗而死于败血症。8月20日,第三名患者在ASPIRO临床试验中死亡,死亡的直接原因是胃肠道出血。
短短3个多月,仅AT132一项ASPIRO试验就有3名儿童死亡,在基因疗法方兴未艾的关键时刻,无疑将对该领域造成负面影响。
AT132是一种含有MTM1基因功能拷贝的AAV8载体,已被FDA授予再生医学和先进疗法(RMAT)、罕见儿科疾病、快速审批通道和孤儿药认证,并被欧洲药品管理局(EMA)授予优先审评药物认定(PRIME)和孤儿药认证。
基因疗法将遗传物质输入到患者体内以修饰引发疾病的基因,进而治疗该疾病。基因疗法的发展和使用病毒载体遗传物质在给患者带来治疗益处的同时,在开发方面也存在挑战。
由于病毒载体的毒力和复制状态差异很大,基因疗法的开发和生产是一项复杂工程。学术研究方面采用的传统技术很难扩大规模,技术挑战加上人才短缺是进一步扩大产能的瓶颈。相对年轻的基因疗法市场在全球高度分散,因此商业上很少有合同研究和制造组织(CMO/CRO)来帮助满足病毒载体的需求和短缺。只有少数几家较大的公司有能力进行规模化生产,而允许公司扩大自身产能的解决方案却受到限制。
从长远来看,需要将重点从“如何安全使用大剂量”转移到“如何设计载体,进而降低类似事件(死亡)发生”。
临床试验屡遭暂停
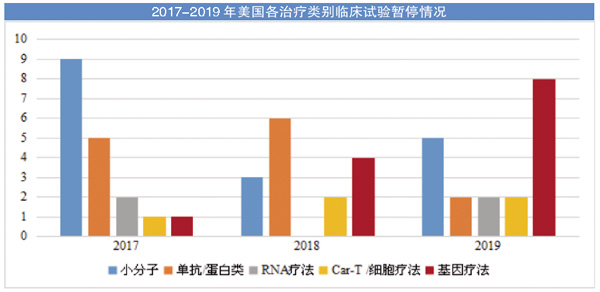
医药市场调研机构Evaluate Pharma对过去3年(2017-2019)生物制药公司新闻稿、季度报告和美国证券交易委员会(SEC)文件以及Vantage报道中披露的信息数据库中关于主要临床试验暂停(Clinical Hold)的分析显示,基因疗法临床试验遭遇暂停的事件增长明显高于其他类别。过去3年中,基因疗法临床试验遭遇暂停的事件分别为1件、4件和8件,总量达13件。虽然低于小分子药物的17件,却与抗体/蛋白类药物数量持平,而且远高于新兴的Car-T/细胞疗法(5件)和RNA疗法(4件)。
在过去3年基因疗法临床试验遭遇暂停的13起事件中,Solid Biosciences公司的杜兴氏肌营养不良症(DMD)基因疗法SGT-001由于不同原因遭遇3次完全或者部分暂停。其中2起涉及SGT-001治疗杜兴氏肌营养不良症的Ⅰ/Ⅱ期IGNITE DMD临床试验。
2018年3月14日,给药后几天,由于实验室检查结果导致患者住院。实验室检查指标异常包括包括血小板计数减少,随后红细胞计数减少以及补体激活。在肝功能检查中,该患者未显示出凝血的体征或症状,也没有相对于基线的相关变化。患者对药物治疗反应良好,随后所有实验室参数均已改善或恢复正常。Solid Biosciences将该事件报告给FDA,而由于出乎意料,FDA将其归为疑似意外严重不良反应(SUSAR)。FDA通知该公司暂停临床试验。
2019年11月12日,在IGNITE DMD临床试验中,有一例儿童发生了严重的不良事件(SAE)。SAE包括血小板计数低、红细胞计数减少、急性肾损伤和心肺功能下降。该试验再次被FDA决定暂停。最终该患者已完全康复,所有临床研究患者都将继续接受监测。2020年4月,Solid向FDA提交了回应信,其中包括对旨在提高患者安全性的临床方案进行更改,以及与改进的生产制造工艺有关的信息。FDA仍旧决定继续暂停临床试验,并要求提供与此制造过程有关的进一步数据和分析。Solid Biosciences正在准备相关数据,并希望在2020年第三季度末之前将此信息提交给FDA。
此外,包括基因疗法公司Regenxbio、Abeona等都有项目遭到FDA通知暂停临床试验数周。
就在8月18日,Biomarin宣布其A型血友病基因疗法Valoctocogene Roxaparvovec收到FDA的完全回应函(CRL),FDA要求其完成2年随访的数据。由于Ⅲ期研究于2019年11月全面招募,最后一名患者将在2021年11月完成两年的随访,意味着该基因疗法最早要到2021年底或2022年初才能获批。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






