医保新政利好哪些创新药? “竞价上岗”怎么办?
发布时间:2020-09-30 17:47:09作者:本报特约撰稿 边界来源:医药经济报
医保新政利好哪些创新药?
“竞价上岗”怎么办?
今年的医保药品目录调整正在快速启动中:8月17日,国家医保局公布《2020年国家医保药品目录调整工作方案》和《2020年国家医保药品目录调整申报指南》;9月18日,公示了728个通过形式审查的申报药品(以下简称“728过形式审查名单”),即将进入专家评审阶段。
从政策来看,医保的推进,以及境外新药数据认可的提升,都给创新药带来利好。既可促进国际多中心临床项目的境内外合作,将较为成熟的产品引进国内市场,还可解救缺少新产品的营销团体。
但是,创新药也将面对“竞价上岗”等新的竞争环境。那么,创新药立项需要关注哪些问题?面对新环境如何筛选项目?
医保政策利好点
7种新增情况,2种与创新药相关
根据《2020年国家医保药品目录调整工作方案》,可以纳入2020年医保药品目录拟新增药品范围有以下7种情况:
1.与新冠肺炎相关的呼吸系统疾病治疗用药。
2.纳入《国家基本药物目录(2018年版)》的药品。
3.纳入临床急需境外新药名单、鼓励仿制药品目录或鼓励研发申报儿童药品清单,且于2020年8月17日(含,下同)前经国家药监部门批准上市的药品。
4.第二批国家组织药品集中采购中选药品。
5.2015年1月1日至2020年8月17日期间,经国家药监部门批准上市的新通用名药品。
6.2015年1月1日至2020年8月17日期间,根据临床试验结果向国家药监部门补充申请并获得批准,适应症、功能主治等发生重大变化的药品。
7.2019年12月31日前,进入5个(含)以上省级最新版基本医保药品目录的药品。其中,主要活性成分被列入《第一批国家重点监控合理用药药品目录(化药及生物制品)》的除外。
对于创新药来说,2020年医保目录调整利好的信息主要有第3种和第5种情况。
临床急需境外新药名单
24个过形式审查,谁能最终进入目录?
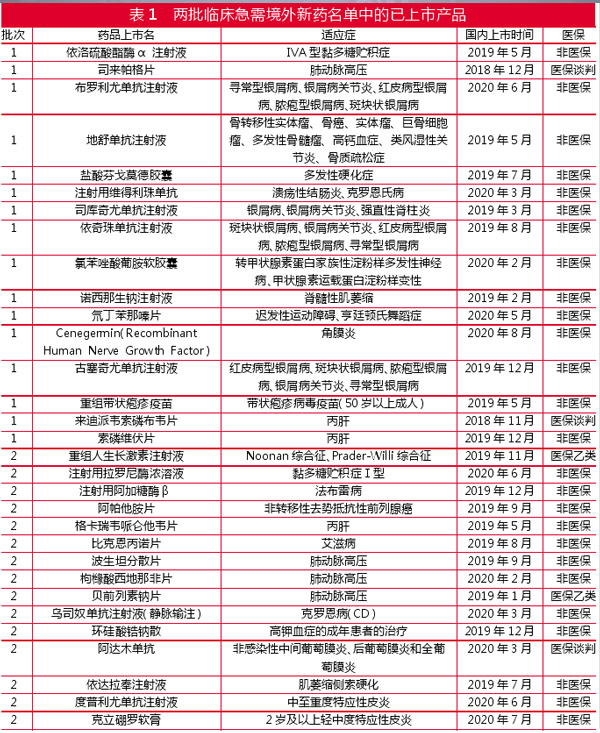
与第3种相关的清单,目前已发布的包括《临床急需境外新药名单(第一批)》、《临床急需境外新药名单(第二批)》、《第一批鼓励仿制药品目录》、《首批鼓励研发申报儿童药品清单》、《第二批鼓励研发申报儿童药品清单》和《第三批鼓励研发申报儿童药品清单》。笔者认为主要利好的是境外新药。
两批“征求意见稿”VS“正式稿”
从数据看,第一批临床急需境外新药名单(征求意见稿)于2018年8月发布,共48个产品进入目录。第一批临床急需境外新药名单(正式稿)于2018年11月公布,被剔除在正式稿外的产品有阿来替尼、依库珠单抗、恩曲他滨/替诺福韦酯艾拉酚胺/艾维雷韦/可比司他、依洛尤单抗、奥拉帕利、哌柏西利、帕博丽珠单抗和特立氟胺8个产品,这些产品都是在正式稿发布前就已获批上市。
第二批临床急需境外新药名单(征求意见稿)于2019年3月发布,共30个产品进入目录。第二批临床急需境外新药名单(正式稿)于2019年5月公布,剔除了征求意见稿的5个产品,并新增了1个产品。新增的产品是NORDITROPIN(somatropin)injection,该产品主要治疗内分泌和代谢疾病努南(Noonan)综合征和普拉德-威利(Prader-Willi)综合征,同样适应症的利维米尔-地特胰岛素注射液被剔除了。第二批目录在正式稿公布前已上市的产品有贝前列素钠片、阿达木单抗、格卡瑞韦哌仑他韦片和西地那非片,预计都是增加适应症。新增适应症预计一般是以申请调整医保支付范围为主。
已上市31个产品,24个过形式审查
两批目录共66个产品,已经上市(含增加适应症)的产品共31个。其中药监局公示2020年8月14日Cenegermin(Recombinant Human Nerve Growth Factor,rhNGF,重组人神经生长因子)获批上市,赶上了2020年医保调整截止日期的最后日期,已进入“728过形式审查名单”。
31个产品中,医保目录相关产品有5个,其中司来帕格片和来迪派韦索磷布韦片进入了医保谈判目录,阿达木单抗在新获批适应症前已经进入医保谈判目录,重组人生长激素注射液和贝前列素钠片则是此前已经有通用名药进入医保乙类。不过,这5个产品中,只有阿达木单抗进入“728过形式审查名单”。
26个非医保类的已上市产品中,有3个产品未进入“728过形式审查名单”,分别是重组带状疱疹疫苗、格卡瑞韦哌仑他韦片和波生坦分散片。
未进入“728过形式审查名单”的7个产品中,有3个是肺动脉高压用药(司来帕格片、贝前列素钠片和波生坦分散片),有2个是丙肝药(来迪派韦索磷布韦片、格卡瑞韦哌仑他韦片)。事实上,丙肝药和肺动脉高压用药都只有1个产品进入“728过形式审查名单”,分别是索磷维伏片和枸橼酸西地那非片。
因此,共24个临床急需境外新药名单的产品进入“728过形式审查名单”。最终有多少可以成功进入最终目录?拭目以待。
聚焦“竞价上岗”
新药立项抉择:适应症?靶点?
第5种情况(即2015年1月1日至2020年8月17日期间,经国家药监部门批准上市的新通用名药品)则既利好境外新药也利好国产新药。
风险地带:相同适应症、相同靶点
从2019年医保谈判的经验来看,同一适应症治疗方案的产品可能会“竞价上岗”,最低价的2~3个方案有望获得医保报销。
2020年2月12日,国家药品监督管理局通过优先审评审批程序批准北京凯因格领生物技术有限公司1类创新药盐酸可洛派韦胶囊上市。盐酸可洛派韦是一种NS5A抑制剂,通过抑制NS5A蛋白而阻断HCV病毒的复制和组装。值得注意的是,医保局已经在2019年将丙肝类药品打包谈判,新药盐酸可洛派韦胶囊要想通过进入医保获得市场,可能需要做好与同类竞品价格战的准备。
新药立项需要有前瞻性的预测,判断新药项目对应的适应症和靶点的研发是否过热。2020年3月阿达木单抗注射液和乌司奴单抗注射液(静脉输注)获批了一个共同的新适应症克罗恩氏病,如果治疗克罗恩氏病的单抗都在我国上市,就非常有可能要进入医保竞价模式。
由此可见,一些热门的相同适应症相同靶点的产品都有可能在2020年面临竞价,例如各靶点的抗肿瘤药,或同通用名但剂型不同的细胞毒注射剂。
可尝试“同类产品、适应症不同”
一些同类的产品,若适应症不同,有可能规避医保谈判中的竞价。例如2020年罗氏的PD-L1阿替利珠单抗是中国首个获批的广泛期小细胞肺癌免疫疗法。阿替利珠单抗(英文名Tecentriq,简称为T药)是国际制药巨头罗氏制药生产的进口抗癌药,是在2019年年底度伐利尤单抗获批上市后,国内批准的第二个PD-L1免疫治疗药。2019年3月,阿替利珠单抗联合化疗(卡铂和依托泊苷),用于一线治疗成人广泛期小细胞肺癌的适应症首次在美国获批,成为近20年来首个被批准用于治疗广泛期小细胞肺癌的药物。
★★★ 小结 ★★★
随着境外新药数据的认可,国产新药和进口新药的竞争会越来越激烈。
国内新药的立项,需要考虑如何规避已经非常热的靶点及领域。特别需要充分评估——相关适应症国内外的患者流动率?拟立项产品有哪些优势符合目前已上市药品未满足的需求?自己的研发团队的研发效率能否抢在进口新药上市前获得生产批件?等等。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






