德国医保控费这么做
发布时间:2020-09-30 17:08:49作者:周若婧 江滨(北京大学公共政策研究中心)来源:医药经济报
费用上涨全球难题何解?
德国医保控费这么做
在全球医药费用上涨的背景下,德国面临着相同的问题,也采取了系列改革以控制医疗和药品费用。
德国门诊用药有专门的报销机制,而住院用药包含在疾病诊断相关分组(DRG)中。门诊控费主要通过“缩小报销范围和降低患者处方费”、“提高处方的经济性”、“控制药品费用”三方面措施实现,其中“控制药品费用”措施包括建立“非专利药的参考定价制度(FRP)”和“专利药的药品市场改革法案(AMNOG)”,以上两制度覆盖了几乎所有上市的处方药。
此外,德国医保目录实行“负目录管理”,排除了部分用药适宜性和经济性较差的药品,如感冒用药、口腔及咽喉用药、通便药、晕车药等。
专利药
首年自主定价,全额报销
一年后执行价格谈判结果
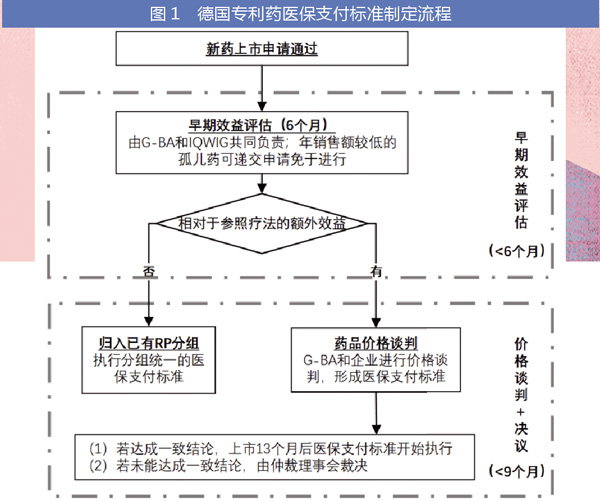
2011年,德国AMNOG法案出台,新活性成分和新适应症申请的药品定价及报销流程也相应改变。之前,企业可自主设定价格,没有直接的价格管控,基本都可报销(仅少数例外)。
而AMNOG的目的是实现“公平价格”,即建立新活性成分药品与其能够提供的患者获益之间的联系。根据AMNOG的限制,新活性成分药品仅在上市后首年可自主定价(保证全额报销);一年后,根据早期效益评价估报销价格谈判结果,新报销价格开始生效。
早期效益评估:决定是否纳入参考定价
若联邦联合委员会(G-BA)认可新药相比适当参照疗法具有额外效益,药企与联邦公立医疗保险公司协会(GKV-SV)可进行谈判,可较参照疗法有溢价。若新药被认定相比适当参照品没有额外效益,则被归入FRP分组(已有合适的FRP分组时)。但此时,新药的年治疗花费不得高于参照疗法的费用。若价格谈判不能达成一致,仲裁委员会对最终报销价格做出裁决。谈判达成或仲裁委员会裁定的价格自第13个月起生效。
其中,早期效益评估环节对专利药医保支付标准的确定至关重要,决定了专利药能否避免纳入参考定价体系,即规避较低的药品医保支付标准。早期效益评估由IQWIG承担,最终额外效益裁决由G-BA负责。
早期效益评估内容主要包括:1)药品相较于参照品在人群中额外效益评估;2)该药品年治疗费;3)目标患者群体规模;4)合理用药的要求。根据四方面评估的结果,得到药品额外效益的程度。因此,在额外效益程度的评估过程中,参照品的定义和确定规则至关重要。
后续价格谈判:参照疗法年费用很重要
在后续的药价谈判中,参照疗法的年费用是谈判最重要的影响因素。但是,下一代可比疗法的年费用,以及其他欧盟国家的实际销售价格都是高度相关的参照。如何解读、分配这些参照价格的权重,则由药企与GKV-SV进行逐个谈判。
非专利药
规定参考价格,每年动态调整
企业自主定价,间接引导企业降价
参考定价(reference pricing)本质上是医保共付或医保控费机制,并不是直接的定价工具。参考定价政策于1989年在德国首次应用,通过一定分组规则将药品划分为不同参考定价分组,并为同组内药品制定相同的参考价作为医保支付限额。企业可以自主定价,患者使用药品的实际销售价高于参考价的部分需由其自行承担。
三级参考定价体系
目前德国非专利药的参考定价体系分为三级,分组方式如表2所示,由联邦联合委员会(G-BA)负责。药品纳入分组后,原则上企业可以通过递交书面材料反对分组,G-BA将组织临床、药学等专家进行听证;也可以通过法律诉讼反对G-BA制定的分组。
由于参考定价政策的目的在于药费控制,因此,部分原仿药价差较小的药品不被纳入参考定价体系。此外,一些罕见病和精神类疾病用药由于分组内药品可替代性较低,未能执行参考定价。参考定价分组实行动态调整,调整周期为一年,动态将新药和新给药途径药品纳入已有分组。
经济激励间接引导
药品分组后,同分组内药品的医保支付标准由联邦公立医疗保险公司协会(GKV-SV)负责制定,该机构是所有公共医疗保险机构的中央管理机构。
通常而言,同组药品的参考价格,不高于同组药品市场价格的下1/3,不低于20%处方量和20%规格数量的价格。
药品出厂价格可由企业自主设定;定价高于医保支付标准时,患者需自行承担超出部分并支付处方费用;价格等于或低于支付标准时,患者仅需支付处方费用;价格低于支付标准的30%时,患者处方费用亦可被豁免。
通过此种经济激励,引导患者使用同分组内相对低价的药品,进而间接引导企业降低药品定价以获得更多的市场份额。
四环节决定参考价格
同分组内药品通常具有多种规格、包装和剂量,这些药品的医保支付标准间需要合理的比价关系。德国药品参考价格的制定包括四个环节:
1.确定标准规格和价格范围:选择大部分药企均生产的剂量和包装对应的规格为标准规格,剔除异常规格,即用量小于1%的规格;
2.标准规格的初始参考价格设定:按照通用原则(即市场价格下1/3)确定标准规格的参考价格上限,低于该值确定初始参考价格;
3.建立回归模型:通过建立回归模型,估算剂量和包装因素对药品价格的影响;基于回归结果,将非标准规格药品的实际价格调整为标准化价格;
4.制定非标准规格的参考价格:根据回归结果和标准规格药品的参考价格计算全部规格的参考价格;检验制定的各品规药品参考价格是否满足高于“20%处方量和20%规格数量产品价格”条件;如果不满足则需要调整标准规格的初始参考价格设定,重复模型估计过程。
GKV每年采集药品销售量及价格,为每年一次参考价格的审查提供最新信息,参考价格组也会根据市场情况及时做出调整。

此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






