欧洲CAR-T产品报销:疗效决定价格
发布时间:2020-09-30 14:58:10作者:廖联明 陈婧来源:医药经济报
2018年8月,欧盟批准了两个CAR-T产品上市,分别为诺华的Kymriah和吉利德的Yescarta。前者获批用于两种适应症:儿童和25岁以下难治、复发B细胞急性淋巴细胞白血病(ALL);成人复发、难治性弥散性大B细胞淋巴瘤(DLBCL)。后者获批用于复发或难治性DLBCL,或难治性纵隔大B细胞淋巴瘤的成年患者。
作为创新性疗法,除了治疗效果,CAR-T产品也因其高昂的定价而备受关注。2019年对于CAR-T产品是个里程碑,因为Kymriah与Yescarta 成功在多个关键国家获得报销。
患者、医学专家、医疗体系的利益相关方如卫生技术评估(HTA)机构和医保机构,以及制药行业都高度关注这些药品的上市。从HTA来看,真实世界的疗效的不确定性需要特别考虑,因为此时只能通过上市前的短期研究数据来判断治疗带来的潜在终身健康获益。疗效的不确定使HTA机构和医保机构无法准确判断什么样的药品价格水平是公平的,什么样的评估方法是合适的,以及对于一次治疗即可获得潜在终身获益的CAR-T产品采用什么支付方式最合理。
高价药市场准入关键点
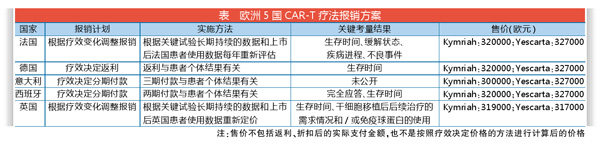
获批上市后一年,这两个CAR-T疗法已经通过了许多欧洲国家HTA机构的评估并完成了报销谈判,报销价格也差不多(见表)。这是真实世界中医疗系统利益相关方处理创新性疗法时,如何在疗效数据不确定性下评估新药的可支付性的典型案例。对Kymriah和Yescarta在5个主要的欧洲国家(法国、德国、意大利、西班牙和英国)的报销和资助计划的分析,也可以推测欧洲对未来其它先进治疗医学产品(ATMP)可能采取的报销政策。
法国:持续收集临床数据
根据早期的“临时用药使用授权”(ATU)法规,法国患者在Kymriah和Yescarta在欧盟上市前就可以使用。根据ATU法规,有特别疗效的新药在获批上市前或在法国进行临床试验前就可以在法国病人中使用,一旦批准上市后,新药则以“ATU后”的方式报销,直到最终决定是否纳入报销范围并确定最终的价格。在ATU和“ATU后”的这段时间,药品生产商可以自由定价,但是价格委员会会制定最高限价。在ATU/ATU后这个阶段税前总销售收入达到3亿欧元的新药会有个支付总额的限定,超过限定后生产商需要给支付方返利。
通过ATU计划收集到的新药安全性和有效性的真实世界临床数据和关键性临床试验的临床数据,将作为HTA机构评估疗效和医保机构决定报销程度的依据。
法国透明委员会(TC)在2018年12月公布了Kymriah和Yescarta的评估结果。TC认为Yescarta在所有注册适应症中具有明显的实际临床获益(SMR),与当前的治疗方法相比有中度的额外临床获益(ASMR)。Kymriah在B细胞ALL治疗上具有明显的SMR,中度的ASMR。在DLBCL治疗上,TC认为Kymriah有明显的SMR,但ASMR非常小。
对于这两个CAR-T疗法,TC委员会要求收集更多的长期数据来解决治疗过程中出现的关于有效性、安全性、复杂性的不确定性问题。因此其推荐建立一项CAR-T专项注册数据库,用来收集更多法国患者的数据重新评估真实世界的健康获益。
另外,法国卫生部门(HAS)也会每年利用注册期间收集的数据和后续关键性试验中的新数据来重新评估ASMR。
2019年7月,Yescarta的报销类别从“ATU后”转变为高价药品增补清单,意味着医院可以获得额外补助。目前Kymriah 还未进入该增补清单,但估计问题不大。
德国:前12月可自主定价
新药上市后的头12个月内企业可以自主定价,在这期间德国联邦联合委员会会进行疗效评估和推荐报销办法,供国家法定健康保险基金协会的后续价格谈判参考,该协会旗下有109家德国健康保险公司。在12个月的自主定价期间,诺华与吉利德都为Kymriah和Yescarta设置了以疗效为基准的返利方法。两个保险联盟VDEK(旗下有6个健康保险资金)和GWQ ServicePlus(旗下有几个中型保险公司)同意了这些返利方法。根据与VDEK签署的“疗效决定价格”的协议,患者经过Kymriah 或Yescarta的治疗后如果死亡,药企将向保险公司返还部分药费;在与GWQ ServicePlus联盟的协议下, 如果Kymriah治疗后一段时间(具体时间未公开)内患者死亡,诺华会支付类似的返利。生存时间目标和返利的多少没有公开,可能约12个月和少于50%。
Kymriah在德国的全国价格谈判于2019年9月15日成功完成,Yescarta于2019年10月3日完成,但确切的金额未披露。
如果医院引进目前DRG收费无法完全覆盖的昂贵的治疗手段时,德国医保系统会给予额外的资助。医院可以与保险公司协商额外的费用。但保险公司只为医院支付药品费用,并不覆盖其他相关花销,如输血、不良反应处置等。这是医院考虑引进CAR-T疗法时的主要顾虑。
意大利:根据患者生存时间分期付款
针对CAR-T产品,意大利药品管理局(AIFA)引进了一种分期付款计划。对于Kymriah,诺华会分3个阶段收到药费(如果患者的生存时间达到了协商的门槛):第一次在输注时,第二次在6个月后,第三次在12个月后。类似的,对于Yescarta,吉利德也会收到三次分期付款,分别在输注后的180天、270天和365天。在患者生存时间不到180天的情况下,吉利德收不到任何付款,这意味着在这项计划里吉利德的Yescarta比诺华的Kymriah要承担更多风险(这可能是因为AIFA认为两种CAR-T疗法的疗效证据不同)。这两个产品的合同有效期都是18个月。AIFA的HTA机构认为这两个产品都是创新性的,这意味着它们自动地包括在区域医保处方集里,受意大利国家创新基金资助。
西班牙:根据真实世界数据分期付款
西班牙卫生部门(MoH)为国家医疗服务体系(NHS)引进了一套新数据收集和管理系统,简称Valtermed。Valtermed注册系统通过网络可以收集真实世界的临床数据,降低新疗法的相关不确定性。
对于Kymriah,西班牙NHS根据Valtermed系统收集的数据进行分期付款:假如患者能对治疗有完全的响应而且疗效能够维持,则第一次付款是治疗开始时(32万欧元的52%),第二次付款在18个月(剩余的48%)。Yescarta与之类似:第一次付11.8万欧元,第二次付20.9万欧元。
英国:通过肿瘤药品基金报销
在英国,Kymriah和Yescarta可以通过肿瘤药品基金(CDF)报销。英国国家卫生和临床技术优化研究所(NICE)认为高不确定性和临床数据的有限性使得这两种产品不能作为推荐常规使用,但建议通过CDF资助治疗。NICE是欧洲5国第一个赞成报销CAR-T的HTA机构,Kymriah在获得上市许可后的10天内就通过CDF获得了报销。不过在厂家提供未公开的折扣和继续收集、提交真实世界证据(RWE)后,NICE和NHS将重新核定报销价格。
2019年1月,Kymriah被SMC(苏格兰医学联合会)作为超孤儿药和临终药进行报销。Yescarta也在2019年11月成功作为超孤儿药和临终药推荐报销。但价格折扣没有公布。
苏格兰的超孤儿药报销法规可提供最多3年的报销。这个阶段后,药企将被要求提供一份最新的疗效数据重新评估,然后SMC会决定药品是否在苏格兰作为常规使用。
RWE重要性凸显
德国向来对疗效决定价格(OBR)的做法持观望态度,但对Kymriah 和Yescarta,德国引进了疗效决定返利的政策。这些计划主要是为了提供一个手段来适应12个月的自主定价期(国家价格谈判同时进行)。调查显示生产商更倾向于在OBR计划阶段结束后提供简单的折扣。
意大利和西班牙依靠患者使用CAR-T治疗的疗效情况进行分期付款的经验是OBR最受关注的例子。这是欧洲5国第一个涉及疗效决定分期付款的国家性报销计划。这些计划的实现显示了生产商和NHS决策制定者前进的意愿,从传统的报销计划(如简单的折扣)走向疗效决定付费,真正维护患者的权益。
从影响报销计划的结果来看,生存时间对于Kymriah和Yescarta在德国的报销是关键,而病人对Kymriah的完全应答是西班牙的报销关键。西班牙致力于将患者提交的QoL(生存质量)评估纳入Valtermed系统,建立成本-效用分析(CUA)。
英格兰和法国使用证据相关报销(Coverage with Evidence Development,CED)计划进行报销,即根据长期持续的试验数据和真实世界的临床实践数据相结合,重新评估未来的定价和报销办法。在英格兰,疗效不确切的抗肿瘤新药在收集附加数据进行价格重新评估的情况下(Kymriah和Yescarta会在5年后进行评估)就可以通过CDF进行报销。CDF的报销模式是使患者最快获得新治疗方法的有效途径,但这只可用于抗肿瘤药。
在法国,初期阶段通过LYSARC平台收集额外数据,通常新药会在5年后重估价格。针对CAR-T疗法,法国卫生部门认为数据非常少,必须每年提交法国病人的数据来重新评估SMR和ASMR。
德国、意大利、西班牙实行的计划,不管是返利还是里程碑式的付款方式,都是基于患者个体的数据,在治疗效果不好的情况下,这对保险机构有利。而法国和英国的保险机构者却要承担更多的风险,因为在价格重估前医保机构已经承诺药费全额报销。
通过收集RWE证明创新疗法的健康获益的重要性也被更多的认识到。制药行业与欧洲5国的NHS决策制定者针对两个CAR-T疗法进入市场的引进方式和报销方法,为今后ATMP的市场准入奠定了基础。Kymriah与Yescarta作为重要的例子,体现了上市时疗效不确定但对患者有巨大获益潜力的创新高价疗法如何引进。尤其是德国、意大利、西班牙的应用,意味着大部分的欧洲国家对OBR打开了大门。
没有万能的解决办法,因为不同的国家有不同的HTA方法和流程,NHS决策制定者有不同的偏好和优先考虑的事情。对于药企和NHS利益相关方,每个新产品都有自己独特的特征和挑战。总之,报销政策应该综合考虑患者、医疗机构、NHS相关利益方和整个制药业的利益。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






