7个抗体新药火线上市 它们有哪些特质
发布时间:2020-09-28 14:51:23作者:李勇来源:医药经济报
7个抗体新药火线上市
它们有哪些特质
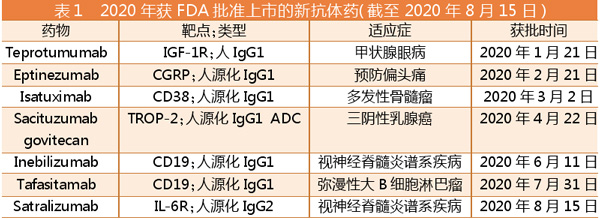
截至2020年8月15日,2020年FDA已批准上市7个新抗体药,分别是Eptinezumab、Teprotumumab、Isatuximab、Inebilizumab、Sacituzumab Govitecan、Satralizumab、Tafasitamab。在新冠疫情的大背景下,这些新抗体药依然如期上市,有的获批时间还比预期提前。
那么,这些火速上市的抗体新药有哪些看点呢?笔者注意到,除了3个抗癌药,在4个非抗癌药中,有2个是用于治疗视神经脊髓炎谱系疾病(NMOSD)的,还有1个用于甲状腺眼病。
Teprotumumab(Horizon)
适应症:甲状腺眼病
Teprotumumab(HZN-001)靶向胰岛素生长因子1受体,用于治疗活动性甲状腺眼病(TED)。TED在某些情况下可导致眼球突出、斜视、复视和失明。FDA已授予Teprotumumab快速通道、突破性疗法和孤儿药认定。
Horizon 已向FDA提交了Teprotumumab作为TED治疗药物的BLA申请,FDA的PDUFA日期是2020年3月8日。而在2020年1月21,FDA提前1个多月批准Teprotumumab的BLA申请。
Eptinezumab(Alder BioPharma)
适应症:预防偏头痛
与已上市的单抗Fremanezumab和Galcanezumab一样,Eptinezumab靶向降钙素基因相关肽(CGRP),用于预防偏头痛。2020年2月21日,FDA如期批准Eptinezumab用于预防偏头痛。
Isatuximab(赛诺菲)
适应症:多发性骨髓瘤
Isatuximab(SAR650984)是一种靶向恶性浆细胞上表达的CD38的嵌合IgG1抗体。该抗体通过多种机制起作用,取决于靶点的表达水平。
FDA的PDUFA日期是2020年4月30日。FDA和EMA均授予其治疗多发性骨髓瘤(RRMM)孤儿药称号。2020年3月2日,FDA提前批准Isatuximab用于治疗RRMM。
Sacituzumab govitecan(Immunomedics)
适应症:三阴性乳腺癌
Sacituzumab govitecan是一种ADC,包含与抗Trop-2抗体偶联的SN38(拓扑异构酶I抑制剂伊立替康的活性代谢产物)。Trop-2在包括三阴性乳腺癌(TNBC)在内的大多数上皮癌中高表达。FDA授予Sacituzumab govitecan突破性疗法和快速通道。
2018年7月,FDA受理了Sacituzumab govitecan的BLA申请,并给予优先审查。2019年1月,FDA发出答复函,要求申请者详细说明与可批准性有关的问题,只是针对化学、生产和控制方面的问题。2019年12月,Immunomedics重新提交BLA。2019年4月,Immunomedics与云顶制药达成独家许可协议,在大中华区、韩国和部分东南亚国家开发、注册和销售Sacituzumab Govitecan。
2020年4月22日,FDA加速批准sacituzumab govitecan用于治疗既往已接受至少2种疗法的转移性三阴性乳腺癌(TNBC)。这是首款获得FDA批准治疗转移性三阴性乳腺癌的靶向TROP-2的抗体偶联药物。
Inebilizumab(Viela Bio)
适应症:视神经脊髓炎谱系疾病
Inebilizumab(MEDI-551)是人源化抗CD19单抗,用于治疗视神经脊髓炎谱系疾病(NMOSD)。
2019年8月,FDA受理了Inebilizumab的BLA审查。Inebilizumab还被FDA授予突破性疗法称号,并被FDA和EMA授予孤儿药称号。2020年6月11日,FDA批准Inebilizumab治疗NMOSD的BLA申请。
Tafasitamab(Morphosys AG)
适应症:弥漫性大B细胞淋巴瘤
Tafasitamab(MOR208)是靶向CD19的Fc工程IgG1抗体,用于复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)。CD19在B细胞恶性肿瘤中表达,如DLBCL和慢性淋巴细胞性白血病(CLL)。Fc工程改造可增强Tafasitamab Fc结构域与活化Fcγ受体的结合,相对于天然的非工程化抗CD19抗体,Fc受体在体外细胞毒性增强。
Tafasitamab被FDA授予突破性疗法和快速通道,并被FDA和EMA指定为治疗复发性/难治性DLBCL的孤儿药。MorphoSys于2019年12月向FDA提交了Tafasitamab联合来那度胺治疗复发或难治性r/rDLBCL的BLA。
2020年7月31日,Tafasitamab的BLA申请获得FDA批准。
Satralizumab(中外制药)
适应症:视神经脊髓炎谱系疾病
Satralizumab是一种人源化抗体,其以pH依赖的方式与IL-6受体结合。NMOSD是一种罕见、终生且使人衰弱的自身免疫性疾病,特征是视神经和脊髓发炎。NMOSD患者经常经历复发,导致累积的神经系统损伤和残疾。Satralizumab被FDA、EMA和日本厚生劳动省(MHLW)授予孤儿药称号。FDA还授予其突破性疗法指定。
2020年8月15日,Satralizumab用于NMOSD的申请获得FDA批准。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






