奔跑吧!单抗生物类似药
发布时间:2020-09-08 15:22:42作者:李勇来源:医药经济报
欧美领航 中国加速
奔跑吧!单抗生物类似药
单抗崛起
在过去的10年里,单抗和肿瘤及免疫疾病无疑是制药行业最为关注的三大焦点,而单抗药物与治疗领域(肿瘤及免疫疾病)二者的高度重合产生叠加效应,进而推动了单抗药物的飞速发展,预计未来数年其仍是制药行业市场增长的主要推动力。
获批数量和占比快速提升
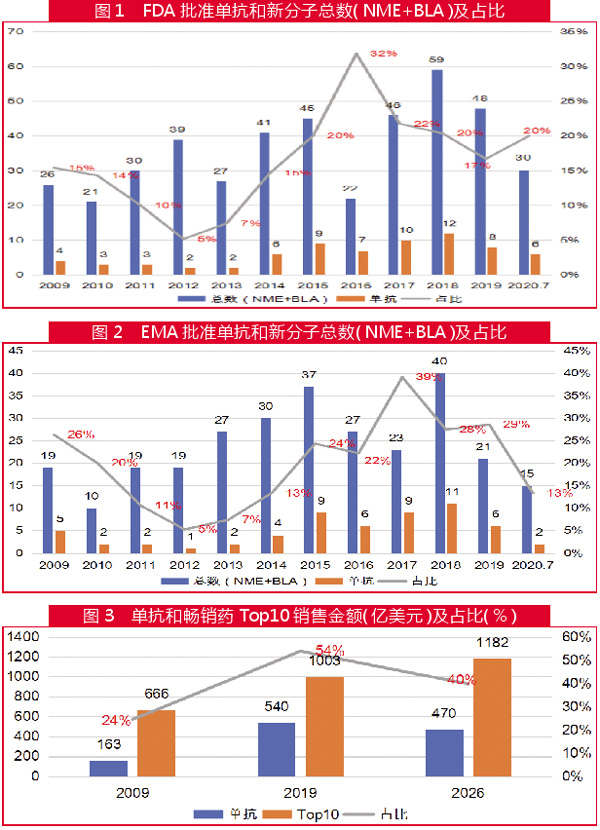
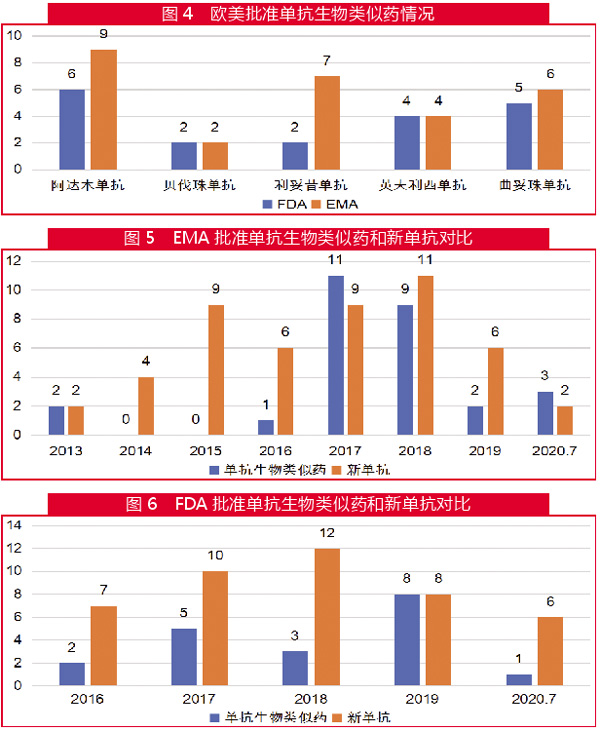
过去的10年,单抗药物开发进入到了“黄金期”,获批数量及占新分子实体和新生物制品(NME+BLA)总数的比例都明显上升。
2009年-2020年7月31日,FDA药物评价和研究中心(CDER)批准的新药中,单抗药物占比除2012年和2013年外,都达到了两位数。在此期间,71款新单抗药物(包括抗体药物偶联物)获批上市,占批准新药的17%(图1)。
而同期EMA批准了59款新单抗药物,虽然数量略少于FDA,但占其批准新药的比例更高,达到了21%(图2)。
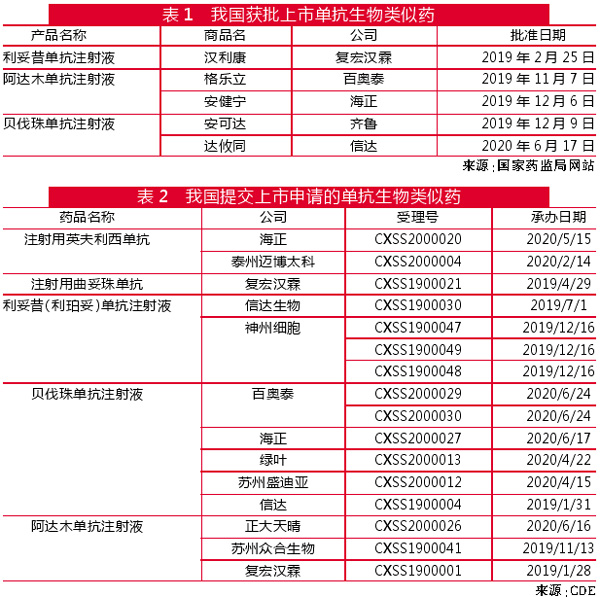
在畅销药TOP10中占比攀升
同时,单抗药物也成为医药市场迅速增长的引擎。从全球畅销药物排行榜前10位(TOP10)的销售额和排序可见一斑(图3):
2009年,3款单抗药物——修美乐(阿达木单抗)、安维汀(贝伐珠单抗)、美罗华(利妥昔单抗)进入当年全球畅销药物排行榜TOP10,位居8~10位,排在榜尾,3款单抗销售金额之和占TOP10的24%。
而到2019年,有5款单抗药物进入畅销药TOP10榜单,除上述3款单抗外,以PD-1/L1单抗为代表的新兴免疫疗法迅速崛起,可瑞达(帕博利珠单抗)和欧狄沃(纳武利尤单抗)分别位居第3位和第8位。与此同时,与多数适应症为肿瘤的其他单抗不同,自身免疫类疾病单抗修美乐连续多年霸占着TOP10榜首位置。5款单抗销售金额之和占该年度TOP10的比例攀升至54%。
根据市场调研机构Evaluate Pharma的预测,2026年可瑞达(帕博利珠单抗)和欧狄沃(纳武利尤单抗)销售额将居畅销药TOP10前两位。另一款单抗达必妥(度普利尤单抗)也会进入TOP10榜单,位居第8位。与2009年相同,都是3款单抗进入畅销药TOP10,但销售金额之和占该年度TOP10的比例明显提升,将达到40%。
近年来,较早上市的单抗专利陆续到期后受到生物类似药侵蚀,多款单抗销售额缓慢下降。与此同时,单抗生物类似药的开发将迎来繁荣期。
欧美先行
欧洲最早批准生物类似药
欧美是制定生物类似药监管要求的领导者,也是最早实施生物类似药监管体系的地区。
2005年,在欧盟完善法律框架下建立的《生物类似药指南》正式生效,成为欧洲乃至全球生物类似药发展史上的新篇章。2013年9月10日,EMA首次批准单抗生物类似药——英夫利西单抗生物类似药Remsima和Inflectra。
在随后的几年里,多款单抗生物类似药在欧洲相继获批上市。目前,5种单抗——阿达木单抗、贝伐珠单抗、利妥昔单抗、英夫利西单抗、曲妥珠单抗的28款生物类似药已在欧盟获批上市,占EMA批准生物类似药(同一上市许可人的同一通用名不同商品名产品合并计算)总数的50%。
美国紧随其后
2010年,美国推出了《生物制品价格竞争和创新法案》(《BPCI法案》),初步制定了生物类似药的审批办法,FDA后续颁布了生物类似药的指南。2016年4月5日,FDA批准首款单抗生物类似药(英夫利西单抗)辉瑞和韩国制药公司Celltrion合作开发的Inflectra。与欧盟一样,也有5种单抗即阿达木单抗、贝伐珠单抗、利妥昔单抗、英夫利西单抗、曲妥珠单抗的19款生物类似药在美国获批上市,占FDA批准生物类似药总数的68%。
单抗生物类似药受青睐
EMA和FDA批准的单抗生物类似药明显多于其他类别(如粒细胞集落刺激因子的非格司亭/培非格司亭、肝素类的依诺肝素钠)的生物类似药。两家监管机构批准5种单抗生物类似药,同期批准的单抗生物类似药数量虽然少于新单抗,但近年呈现明显上升趋势。
中国速度
法规和指南建设加速
2015年2月,原国家食品药品监督管理总局发布了《生物类似药研发与评价技术指导原则(试行)》。虽然比欧盟自2005年率先建立生物仿制药审批通道晚了十年,却是我国监管机构首次明确了生物类似药的定义,提出了生物类似药研发和评价的基本原则。
2020年7月1日起施行的新版《药品注册管理办法》中,生物制品注册按照生物制品创新药、生物制品改良型新药、已上市生物制品(含生物类似药)等进行分类。
将于今年12月1日起施行的《生物制品注册分类及申报资料要求》注册分类中可以明确按照治疗用生物制品“3.3生物类似药”注册。
国家药监局药审中心7月20日同时发布曲妥珠单抗和利妥昔单抗生物类似药临床试验指导原则;8月3日发布了贝伐珠单和阿达木单抗生物类似药临床试验指导原则。今年以来,国家药监局药审中心共发布了5个品种(包括利拉鲁肽)的生物类似药临床试验指导原则。今年上半年,国家药监局药审中心网站还发布了地舒单抗(骨质疏松适应症和恶性肿瘤适应症)、托珠单抗、帕妥珠单抗3个品种4份生物类似药临床试验指导原则(征求意见稿),有望近期公布正式稿。
国家药监局药审中心陆续发布相关单抗品种生物类似药临床试验指导原则,进一步扫清了该类产品的申报审批障碍。
获批5款,排队等待上市
在此之前,国内已有多款治疗用单抗生物制品按生物类似药申报,目前已有5款单抗生物类似药产品获准上市。
2019年可以是说是中国生物类似药的元年,共有4款单抗生物类似药获批。2019年2月25日,NMPA批准复宏汉霖的汉利康(利妥昔单抗注射液)上市,该药是复宏汉霖旗下自主研发的首个单抗药物,也是首个国产生物类似药。之后,百奥泰生物的格乐立(阿达木单抗注射液)、海正药业的安健宁(阿达木单抗注射液)和齐鲁制药的安可达(贝伐珠单抗注射液)于2019年11月7日、12月6日、12月9日先后获批上市。这也标志着中国2019年在生物类似药领域迎来了突破性进展。
今年6月17日,信达生物的达攸同(贝伐珠单抗注射液)获得NMPA的上市批准。至此,2019年前提交上市申请的单抗生物类似药全部获得批准(表1)。
此外,国内还有多家企业进行单抗生物类似药的开发,2019年来已提交上市申请的包括:阿达木单抗注射液4家、贝伐珠单抗注射液4家、利妥昔单抗注射液2家、注射用曲妥珠单抗1家、注射用英夫利西单抗2家(表2)。
2020年7月27日,复宏汉霖与合作伙伴Accord Healthcare发布公告称,欧盟委员会已批准复宏汉霖自主开发和生产的曲妥珠单抗(HLX02,欧盟商品名:Zercepac)上市,该药获得原研药在欧盟批准的所有适应症,即HER2阳性早期乳腺癌、HER2阳性转移性乳腺癌及HER2阳性转移性胃癌。这表明,我国单抗生物类似药已经有了在欧美市场与全球跨国药企同台竞争的实力。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






