MAH制度“解锁” 药品批文交易激活在即
发布时间:2020-09-03 10:42:26作者:本报特约撰稿 边界来源:医药经济报
药品上市许可持有人(Marketing Authorization Holder,MAH)药品上市后将如何变更,即将有新的文件依据。7月31日,国家药监局对《药品上市后变更管理办法(试行)(征求意见稿)》(以下简称“征求意见稿”)公开征求意见。
《药品上市后变更管理办法(试行)》一旦正式发布,原国家食品药品监督管理局发布的《关于印发药品技术转让注册管理规定的通知(国食药监注〔2009〕518号)》、《关于做好实施新修订药品生产质量管理规范过程中药品技术转让有关事项的通知》(国食药监注〔2013〕38号)废止,MAH制度将取代过往的药品技术转让方式。
由此,国内药品批文的买卖市场有望被激活。特别是“征求意见稿”并没有要求化学药的技术转让必须要和原研药一致,而是要求“持有人变更后,药品的生产场地、处方、生产工艺、质量标准等应与原药品一致”。这将可能使得一些化学药的“僵尸批文”有交易价值。
而利好的背后,有哪些需要注意的问题呢?
焦点1:例外的“毒性药品”
在“征求意见稿”第三十二条中,明确了“例外情形”,即医疗用毒性药品、麻醉药品、精神药品、放射性药品、药品类易制毒化学品、疫苗、生物制品等。对于这些药品的变更管理,“有专门规定的,从其规定”。
其中,医疗用毒性药品(以下简称“毒性药品”)系指毒性剧烈、治疗剂量与中毒剂量相近,使用不当会致人中毒或死亡的药品。其相关管理办法《医疗用毒性药品管理办法》(中华人民共和国国务院令第23号)为国务院于1988年12月27日发布并实施,至今已有三十多年。
《医疗用毒性药品管理办法》提到,凡加工炮制毒性中药,必须按照《中华人民共和国药典》或者省、自治区、直辖市卫生行政部门制定的《炮制规范》的规定进行。药材符合药用要求的,方可供应、配方和用于中成药生产。
毒性中药品种包括砒石(红砒、白砒)、砒霜、水银、生马前子、生川乌、生草乌、生白附子、生附子、生半夏、生南星、生巴豆、斑蝥、青娘虫、红娘虫、生甘遂、生狼毒、生藤黄、生千金子、生天仙子、闹阳花、雪上一枝蒿、红升丹、白降丹、蟾酥、洋金花、红粉、轻粉和雄黄。
值得注意的是,马兜铃酸的药材也属于被管控的。2004年《关于加强广防己等6种药材及其制剂监督管理的通知》中提到,暂停受理含马兜铃、寻骨风、天仙藤和朱砂莲等4种药材的中成药的中药品种保护申请和已有国家标准药品的注册申请,暂停受理含上述4种药材制剂的新药注册申请。抗艾滋病病毒和用于诊断、预防艾滋病的新药,治疗恶性肿瘤、罕见病等的新药以及治疗尚无有效治疗手段的疾病的新药等特殊情况除外。
2017年,国家食品药品监督管理局官网公布了含有马兜铃属药材的已上市中成药品种名单和可能含有马兜铃酸的马兜铃科药材名单。其中,含有马兜铃属药材的已上市中成药品种名单主要对应药材为大青木香、九月生、马兜铃、蜜马兜铃、木香马兜铃、寻骨风和朱砂莲。上述药材及相关中成药很大程度将属于不可转让的范畴。
西药毒药品种则仅指原料药,不包含制剂,包括去乙酞毛花贰丙、阿托品、洋地黄毒贰、氢澳酸后马托品、三氧化二砷、毛果芸香碱升汞、水杨酸毒扁豆碱、亚砷酸钾、氢澳酸东菩莫碱、士的年。其中,士的年、阿托品、芸香碱等包括盐类化合物。
焦点2:更严的“生产单位变更”
管理职责有变化
国家药品监督管理局负责组织制定药品上市后变更管理规定和有关技术指导原则,指导持有人对药品上市后变更进行研究;负责药品上市后注册管理事项重大变更及境外生产药品的中等和微小变更管理,依法组织实施对药品上市后变更的监督管理。
省级药品监督管理部门依职责负责辖区内持有人药品上市后变更的许可、备案、报告等管理工作,依法组织实施对药品上市后变更的监督管理。
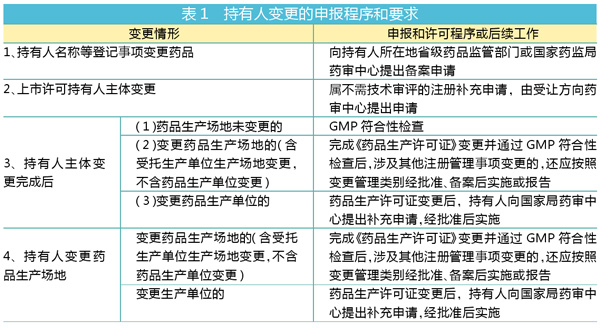
如表1所示,除了“持有人名称等登记事项变更药品”的个别事务,药品上市许可持有人的申报和许可程序基本上都需要向国家局药审中心提出申请。
此前,药品技术转让往往是直接向省局或者国家局申请,省局或国家局现场考核完成《药品生产许可证》变更并通过GMP符合性检查的拟变更的药品生产场地,经批准后即可发新的药品注册证书。
这类药品技术转让往往发生在两个不同生产单位之间。而上市许可持有人主体变更,无论生产场地有无发生变更,但药品生产单位不变的,在原有法规是不允许的。《药品上市后变更管理办法(试行)(征求意见稿)》打破了上述枷锁。
哪种流程更快?
那么,对于两个不同生产单位的上市许可持有人的变更,现有流程是怎样的呢?
预计会有两种路径:
一是先做上市许可持有人主体变更,主体变更成功后,再变更药品生产单位。
二是先变更生产单位,再申请上市许可持有人主体变更。
其中,“路径一”往往是受让方更为偏好的。对于受让方而言,“路径一”可以充分了解产品是否属于不予许可变更的范围,而且能更快成为药品上市许可持有人。
生产场地变更≠生产单位变更
值得注意的是,根据“征求意见稿”,在申报程序和要求的管理上,“生产场地变更”与“生产单位变更”是不同的。
根据“征求意见稿”第十六条,“生产单位变更”包括变更委托生产单位、增加委托生产单位、持有人自行生产变更为委托生产、委托生产变更为自行生产。“生产单位变更”应按照有关规定在生产许可证变更完成后按照有关变更技术指导原则要求完成研究,之后向国家药审中心提出补充申请。国家药审中心根据审评需要组织现场核查和抽取样品进行检验。
“征求意见稿”第十四条对“生产场地变更”给出了定义,是指持有人药品生产许可证、药品批准证明文件载明的生产场地(含自有生产场地、受托方生产场地)地址、位置的变更,包括原址或者异地迁建、新建、改建和扩建车间或生产线。按照这个定义,药品生产场地变更也包括生产单位的变更。
不过,对于申报程序和要求的管理,“生产场地变更”与“生产单位变更”二者是分列的。在表1中,“变更药品生产场地的(含受托生产单位生产场地变更,不含药品生产单位变更)”;对“生产场地变更”的管理,要依据变更管理类别进行申报调整。“生产单位变更”要经国家药审中心批准。
这意味着同一集团内部的两个子公司之间的生产单位变更,总公司和子公司之间的生产单位变更,都需要面临国家药审中心的技术审评,根据审评需要组织现场核查和抽取样品进行检验。对于同一集团下的生产单位变更,“征求意见稿”的政策较MAH试点阶段的政策严格。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






