寻找创新药“基因密码”
发布时间:2020-08-25 13:26:23作者:徐轩来源:医药经济报
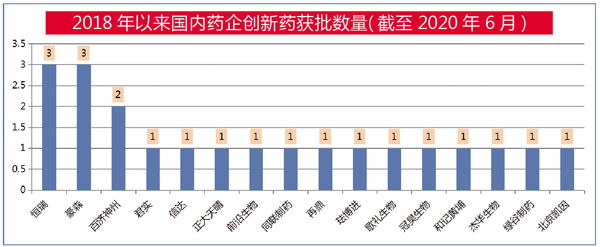
2018年至今年6月,国内批准上市的国产创新药有21个。其中,2018年有9个,2019年有9个,2020年1-6月有3个,适应症主要集中在抗肿瘤、抗病毒、慢性病等治疗领域,部分上市品种属于国际前沿研究领域。涉及企业有16家,其中恒瑞有3个、豪森有2个、百济神州有2个、其它13家企业各1个。
恒瑞:3个
[代表药] 艾瑞妮、艾立妥、瑞倍宁
艾瑞妮(吡咯替尼):2019年销售额近30亿元
2018年8月,恒瑞的马来酸吡咯替尼片获得国家药监局有条件批准上市,商品名为“艾瑞妮”,剂型为片剂,规格为80mg、160mg,主要用于治疗复发或转移性乳腺癌。该产品是我国自主研发的创新药,通过优先审评审批程序获准上市。年报数据显示,该药累计研发费用7.4亿元,目前仍有多种适应症处于临床研究阶段。
乳腺癌是全球女性癌症中发病率较高的恶性肿瘤,其治疗市场具有很大潜力。吡咯替尼由于临床疗效表现出色,被誉为口服“赫赛汀”,加上乳腺癌市场空间较大,该产品已成为恒瑞继阿帕替尼之后又一重磅创新药品种。吡咯替尼已进入2019版国家医保目录,使用范围为限表皮生长因子受体2(HER2)阳性的复发或转移性乳腺癌患者的二线治疗。2019年吡咯替尼销售额近30亿元。
艾立妥(卡瑞利珠单抗):已获批4个适应症
2019年5月,恒瑞PD-1单抗卡瑞利珠单抗获得国家药监局批准上市,商品名“艾立妥”,用于复发/难治性霍奇金淋巴瘤三线治疗。2020年3月,卡瑞利珠单抗又获得肝细胞癌适应症。这是国产第三家获批的PD-1产品。
2020年6月,卡瑞利珠单抗获批两项新适应症:一是二线治疗晚期食管鳞癌;二是卡瑞利珠单抗联合培美曲塞加卡铂一线治疗晚期或转移性非鳞非小细胞肺癌。至此,卡瑞利珠单抗已在中国获批4个适应症。
随着恒瑞PD-1产品入局,境内和境外PD-1产品在相近水平线上博弈,中国市场上PD-1战火无疑会烧得更旺。目前恒瑞PD-1凭借肿瘤领域的渠道优势, 2019年销售额已突破10亿元,未来随着多个适应症及联合疗法上市,市场前景广阔。
瑞倍宁(瑞马唑仑):全球首个上市瑞马唑仑分子
2019年12月,恒瑞医药的1类新药注射用甲苯磺酸瑞马唑仑上市,商品名为“瑞倍宁”,主要用于患者的静脉麻醉,效果比丙泊酚更佳,而且适应症可扩展至镜检时镇痛、术前麻醉和ICU镇静。
甲苯磺酸瑞马唑仑为苯二氮 类药物,作用于GABAA受体,是我国自主研发并拥有自主知识产权的创新药。甲苯磺酸瑞马唑仑是全球第一个上市的瑞马唑仑分子,将为常规胃镜检查镇静提供新的用药选择。
瑞马唑仑最早由德国Paion AG公司开发,是一种短效苯二氮 类GABA(A)受体激动剂,用于手术中的全身麻醉。目前丙泊酚是国内麻醉镇静领域应用最广、市场份额最大的品种,多年来一直保持较快增速。甲苯磺酸瑞马唑仑依托强大平台,将成为恒瑞医药新的业绩增长引擎,并带动在研产品管线中储备药物的成长,整合静脉/吸入麻醉产品线,是一款极具开拓意义的药物。
豪森:3个
[代表药] 孚来美、豪森昕福、阿美乐
孚来美(聚乙二醇洛塞那肽):首个国产长效GLP-1
2019年5月,豪森自主研发的创新药聚乙二醇洛塞那肽注射液获准上市,商品名为“孚来美”,该产品是首个国产长效GLP-1受体激动剂。
豪森的聚乙二醇洛塞那肽降糖疗效明确,安全性高,且每周仅需注射一次。孚来美是通过豪森聚乙二醇化修饰专有技术上市的首个创新药,为后续该技术的应用树立了更大信心。
豪森昕福(氟马替尼):由仿到创升级之路
2019年11月,豪森自主研发的重磅创新药甲磺酸氟马替尼片获得国家药监局批准上市,商品名为“豪森昕福”。
该产品是第二代BCR-ABL酪氨酸激酶抑制剂(TKI),为伊马替尼的升级版。由首仿药伊马替尼到创新药氟马替尼,豪森药业走出了由仿到创的升级之路。
阿美乐(阿美替尼):首个国产三代EGFR-TKI抑制剂
2019年11月,豪森自主研发的甲磺酸阿美替尼片获得国家药监局批准上市,商品名为“阿美乐”。
该产品为首个国产三代EGFR-TKI抑制剂,直接竞品为奥希替尼。奥希替尼2019年全球销售额超过30亿美元。作为中国领先的创新型制药公司,豪森药业在抗肿瘤领域耕耘多年且收获颇丰。
百济神州:2个
[代表药] 百泽安、百悦泽
百泽安(替雷利珠单抗):借小适应症快速上市
2019年11月,百济神州的替雷利珠单抗获得国家药监局批准上市,商品名为“百泽安”,适应症为用于治疗复发/难治型经典型霍奇金淋巴瘤。
2020年4月,替雷利珠单抗又获得尿路上皮癌适应症,凭借小适应症快速进入市场。
百悦泽(泽布替尼):中国抗癌原研药首次出海
2019年11月,百济神州宣布其自主研发的抗淋巴瘤新药泽布替尼获得美国FDA加速批准上市,商品名为“Brukinsa”,治疗经治的套细胞淋巴瘤(MCL)患者,成为首款获 FDA 批准的中国本土原研抗癌药。
泽布替尼是FDA批准的首个完全由中国企业自主研发的抗癌新药,也是百济神州首个获批的自主研发新药。百济神州BTK抑制剂泽布替尼为中国原研抗癌新药出海带来了新的突破。
2020年6月,百济神州BTK抑制剂泽布替尼胶囊获得国家药监局批准,用于治疗既往至少接受过一种疗法的成人套细胞淋巴瘤(MCL)患者、既往至少接受过一种疗法的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者。该产品在国内获批时间与美国相差不到7个月。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






