医械标准立项完成89.4%
发布时间:2020-08-06 10:52:39作者:本报记者 胡睿 发自北京来源:医药经济报
国家药监局发布“中国医疗器械标准管理年报(2019)”
医疗器械标准是医疗器械研制、生产、经营、使用以及监督管理所共同遵循的技术规范,是医疗器械监管和产业发展的重要技术支撑。
为贯彻落实“十三五”国家药品安全规划,每年完成约100项医疗器械标准制修订任务,国家药品监督管理局按照《医疗器械标准管理办法》和《医疗器械标准制修订工作管理规范》有关要求,组织、指导医疗器械标准化(分)技术委员会或技术归口单位按时保质完成标准制修订任务。
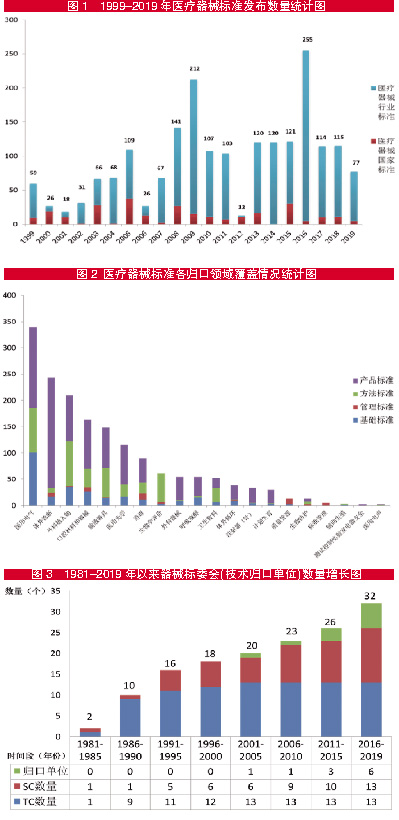
《年报》数据显示,“十五”“十一五”和“十二五”期间分别发布医疗器械标准292项、553项和476项。“十三五”即将收官,截至2019年底,“十三五”规划中500项医疗器械标准制修订任务已经完成立项447项,占到总完成量的89.4%。1999-2019年20年来医疗器械标准发布数量稳步增长,见图1。
相关负责人表示:“经历了起步发展期和高速度增长期后,医疗器械标准技术体系从体量上看已基本满足监管和产业发展需求,随着科技进步、产业发展和监管理念的转变,医疗器械标准已走上质量效率并重的集约型发展道路。”
强制性标准达395项
医疗器械标准基本覆盖医用电气设备、手术器械、外科植入物等医疗器械各技术领域。
按照标委会(技术归口单位)归口领域,标准数量排名前5位的分别是:医用电气设备领域339项(20.3%),体外诊断领域243项(14.5%),外科植入物领域209项(12.5%),口腔材料和器械163项(9.8%)和输液器具领域148项(8.9%)。
在各归口领域中,根据不同领域的标准需求,标准类别有所不同,医用电气设备、呼吸麻醉领域的基础标准占比较高,均达29.0%;医疗器械标准管理和质量管理领域的管理标准占比最高,分别为100%和85.7%;医疗器械生物学评价领域的方法标准占比最高,达90.2%;计划生育和体外诊断医疗器械领域的产品标准占比最高,分别为86.2%和86.0%。医疗器械标准各归口领域覆盖情况统计图,见图2。
采访中,记者了解到,近年来,随着医疗器械标准逐步完善,标准约束力也更加优化,强制性标准也在不断增加。
截至2019年底,医疗器械强制性标准共395项,其中国家标准85项,行业标准310项。2019年国家药品监督管理局根据国务院强制性标准整合精简结论,发布《关于〈医用诊断X射线辐射防护器具 第1部分:材料衰减性能的测定〉等40项强制性医疗器械行业标准转化为推荐性行业标准的公告》(2019年第106号),转化为推荐性的40项标准中,产品标准23项(占57.5%),方法标准7项(占17.5%),管理标准1项(占2.5%),基础标准9项(占22.5%),医疗器械标准技术体系进一步优化。
相关负责人表示:“近年来,医疗器械标准相关法律法规相继制修订,基本建成了内容科学、程序严密、配套完备的医疗器械标准法规制度体系,形成了纵向维度效力层级明晰、横向维度主体范围明确的医疗器械标准法规制度体系。”
2019年针对标准制修订关键环节,结合工作实际,制定印发《医疗器械标准化工作档案管理要求》《医疗器械标准审核要点》《医疗器械标准化技术委员会考核评估细则》,修订了《医疗器械标准验证工作细则》《医疗器械标准报批材料审核工作流程》。在医疗器械标准法规体系的基础上进一步细化规范性要求,推动医疗器械标准全过程精细化管理向纵深发展。
现有标委会32个
相关负责人介绍:“标委会(技术归口单位)是医疗器械标准制修订的承担主体,也是医疗器械标准体系组织架构的重要组成部分。”
《年报》显示,2019年,全国外科植入物和矫形器械标准化技术委员会有源植入物分技术委员会(SAC/TC 110/SC4)和全国医疗器械生物学评价标准化技术委员会纳米医疗器械生物学评价分技术委员会(SAC/TC 248/SC1)2个分技术委员会获国家标准化管理委员会批准成立;医用电声设备、医用增材制造技术、人工智能医疗器械3个医疗器械标准化技术归口单位获批成立。
从1980年第一个医疗器械标准化技术委员会成立以来,经过40年的发展,标委会数量已逐步增长到32个,医疗器械标准工作领域不断拓展,医疗器械标准组织架构进一步完善,有利于充分发挥新形势下医疗器械标准的引领作用和技术支撑作用。1981-2019年以来器械标委会数量增长图,见图3。
近年来,我国医疗器械国际标准一致性程度也在持续提升。
据统计,截至2019年底,我国应转化的医疗器械国际标准(ISO和IEC标准)共670项(其中28项为2019年以来新发布的国际标准),我国已经转化或者正在转化中的医疗器械国际标准共582项。除2019年新发布国际标准外,我国应转化的医疗器械国际标准转化率达90%。
另外,为扩大标准立项项目来源,国家药监局鼓励医疗器械生产经营企业、使用单位、监管部门、检测机构以及有关教育科研机构、社会团体和个人等提出立项提案,可以通过标管中心网站医疗器械标准立项提案申请入口提交。标委会也会及时公布下一年度医疗器械标准立项项目征集通知,进一步扩大立项项目征集范围。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






