生物类似药带量采购将至? 先回答三个焦点问题
发布时间:2020-08-06 10:39:36作者:本报特约撰稿 白小空来源:医药经济报
中药和生物制品都要集采的信息引来业界热烈讨论。
生物类似药能否像化学仿制药那样取代原研产品,是生物制品进入集采的关注重点。
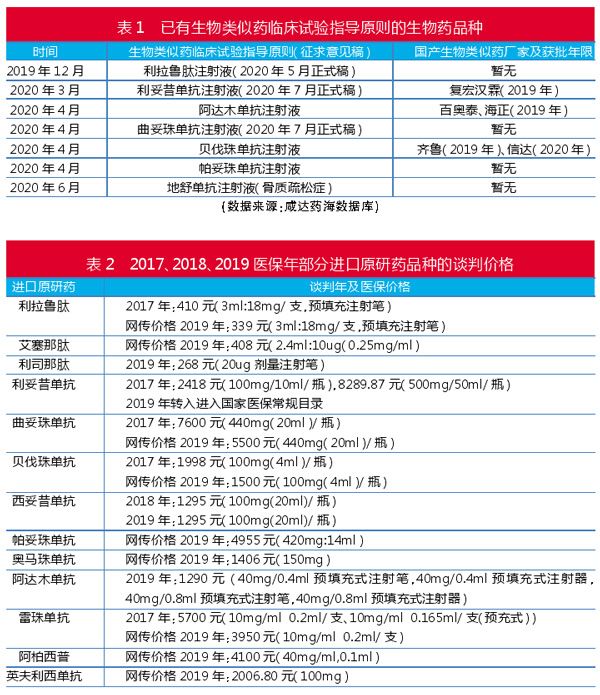
2019年可谓生物类似药元年,2019年2月22日复宏汉霖的“汉利康”获批上市,成为中国批准的第一款生物类似药。自2015年《生物类似药研发与评价技术指导原则(试行)》发布以来,2019年起终于发布了一系列具体产品的生物类似药临床试验设计指导原则。生物类似药临床试验设计指导原则主要针对的是生物类似药的上市标准。
近日医保部门对生物药是否进入带量采购的讨论会之所以引起强烈关注,是因为几个基本问题:生物类似药是否可以直接替代原研生物药,参与带量集采?哪些品种在何种条件下,可望成为第一批可替代的生物类似药?
欧美放开“互换”了吗?
没有。欧美只是放开了生物类似药的注册上市政策
与化学仿制药所要求的原料、辅料基本与参照原研药完全一致的情况不同,生物类似药具有分子量大、结构复杂、不易定性的特点,几乎不可能“仿制”出完全相同的分子结构,只能保证与原研生物药的“相似性”。但是,由于小分子药物和大分子药物存在本质区别,传统的评价化学仿制药生物等效性的方法亦不适合生物类似药。
那么,欧美是否建立了生物类似药的“互换性”评价机制呢?
事实上,对于生物类似药的互换性问题,目前全球仍未达成一致。
欧盟是全球最早制定生物类似药指导原则的地区。2004年欧盟发布了第一版《生物类似药指南(草案)》,并在2005年生效。该指导原则的颁布极大推动了首个生物类似药的上市。2006年4月12日,由山德士研发的全球第一个生物类似药重组人生长激素(Omnitrope)在欧洲上市。
在美国,从1986年第一个治疗性单克隆抗体药物上市,到2006年才有第一个生物类似药上市,生物类似药领域的监管政策“真空”状态持续了20年。美国放开生物类似药的监管,一个主要原因是欧盟生物类似药政策的“倒逼”。
在美国,虽然FDA在2018年发布了《生物类似药行动计划》(Biosimilars Action Plan,BAP),列出了11项行动计划,包括生物类似药标签及证明“可替代性”的最终指南或修订指南草案,然而,FDA尚未发布如何证明“可替代性”的最终指南,而且暂无标签为“可替代性”的生物类似药上市。
对于生物类似药能否替代原研生物药,美国要求由州政府层面决定,并可参照美国的《生物制品价格竞争与创新法案》,药房有一定的替代权,但最终还是医生拥有治疗决定权。
这一点其实和欧盟一致:在欧盟,可互换性政策由各个成员国制定;而所有欧盟国家在官方立场上肯定了处方医生作为生物类似药与原研药品转换的发起者和监督者的作用。
也就是说,目前欧美对生物类似药放开的,主要是注册上市的政策。尽管欧美政策放开了生物类似药上市的门槛,但生物类似药并不能像化学仿制药那样直接与原研药品进行互换。
生物类似药能否带量采购?
“互换性”还在摸索中,目前还不能取代原研生物药
近日业界强烈关注的“生物药能否进入带量采购”的讨论,其实就是生物类似药的市场替代问题。那么,生物类似药能否在我国临床市场上取代原研生物药呢?
从目前国内政策来看,未来可能突破的政策主要有两个方面:
一是按通用名确定的医保目录以及对应的医保药品支付标准中,生物类似药和原研药品属于同通用名,理论上可以相互替换。
另一方面就是我国独有的带量采购政策中,生物类似药是否应该和原研药以同通用名一并竞争。
这两项政策都属于非医疗切换的自动替代。特别是医保支付价一旦确定,患者选择原研药品需要自费支付与生物类似药之间的差价,患者可能会主动接受自动切换。
而生物类似药的“自动切换”,需要满足四个属性:1)生物类似药是原研生物药的类似物;2)生物类似药预期在任何患者身上产生与原研药同样的临床效果;3)生物类似药在同一患者效果递减的风险不比原研药更高。4)可互换的生物类似药不经医生的干预就可以与原研药互换。
除了上市的Ⅲ期随机双盲对照“头对头”临床试验证明生物类似药的有效性和安全性,美国认为生物类似药的可互换性可能要补充试验:观察生物仿制药与原研生物药之间的两次或更多次的替换是否影响治疗过程的安全性或疗效。临床试验如何设计?真实世界数据的研究是否可以作为佐证?一切都还在摸索中。
生物类似药上市需要做的Ⅲ期临床研究成本很高,如果还需要做可互换性试验来论证可行性,无疑是为生物类似药的使用再加多一道门槛。
我国的生物类似药是否可互换,药品审评部门或卫生管理部门均未出台明确规定。同时,除处方医生外,我国医保定点零售药店中的药师是否有权将生物类似药与其原研药进行互换仍然有待考量。
医保支付价格如何制定?
从经济上推动非医疗替代,并积累相关的临床数据
2017年、2018年、2019年的医保谈判价格可见,进口原研产品每次续约都要接受降价,同类产品往往也要被医保部门互相竞争降价幅度。鉴于2019年医保谈判价格是保密状态,网上传闻的胰高血糖素样肽-1(GLP-1)类似物价格已经在200元~400元之间。
已有生物类似药上市的阿达木单抗,原研药的医保谈判价格已经在1290元,生物类似药的价格预计会在1000元以下。
在法国,生物类似药上市后,医院渠道的生物类似药价格必须不高于原研药价格;并且,生物类似药上市后,原研药应当强制性降价至少10%,而且医院的采购价格必须每18月~24月对两种产品(参照品和类似药)进行价格修订。零售渠道方面,生物类似药的价格预计比原研药的初始价格低25%~35%。生物类似药上市后,原研药强制性降价至少15%~20%。
短期内,更应该制定的是生物类似药的医保支付价格。而且,根据医保支付价格,原研药品可报销的适应症和生物类似药可以有所区隔。例如苏格兰的英夫利昔单抗原研药只能报销牛皮藓、儿童克罗恩病和儿童溃疡性结肠炎;生物类似药除了可以报销上述适应症,还可以报销类风湿关节炎、银屑性关节炎、成人强直性脊柱炎、成人克罗恩病和成人溃疡性结肠炎等。
总结<<<
我国正处于生物类似药上市法规相对较为清晰,但市场监管方的可转换性政策尚未明朗,处方医生组织和药师组织已经发布了可互换的共识的阶段。
目前我国的生物类似药才上市不久,所积累的患者临床数据并不足以判断是否能完全取代原研生物药。建议先从生物类似药的医保支付价格标准制定起步,从经济上推动非医疗替代,并积累相关的临床数据。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






