儿童药新政释放新利好
发布时间:2020-07-15 16:26:32作者:本报特约撰稿 边界来源:医药经济报
儿童药新政释放新利好
改剂型?特殊剂型?特殊规格?新药?四大研发热点PK
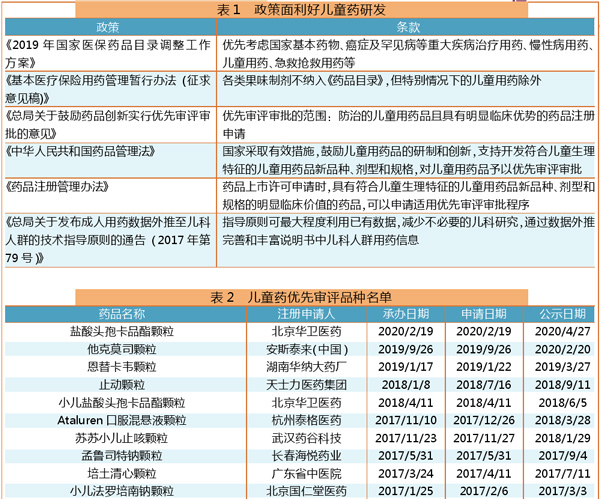
近几年,儿童用药成为了各家关注的研发方向。国内政策也逐步利好于儿童药方向,无论是医保还是药品注册都出台了相关政策(含征求意见稿),如表1所示。
5月18日,CDE发布关于公开征求《真实世界证据支持儿童药物研发与审评的技术指导原则(征求意见稿)》意见的通知。这是自2020年国家药监局关于发布真实世界证据支持药物研发与审评的指导原则(试行)的通告(2020年第1号)发布后的第一份关于真实世界应用的技术指导原则。为此,业界有观点认为,儿童药的真实世界研究将推动更多儿童药更快上市。
那么,真实世界研究的此项政策究竟对儿童药产业有多大利好?儿童药未来的研发方向在哪里?
真实世界研究,谁的利好?
注意事项:不能作为新药上市的依据
事实上,征求意见稿对儿童药真实世界研究的应用方向给出了指引。
根据征求意见稿,在儿童药物研发中,真实世界证据的应用较常出现在以下五种情形:
1)长期用药风险监测,如药物对儿童生长发育的影响;
2)为满足儿童多样化需求的合并用药、合并用食物等研究;
3)临床实践中已积累大量数据,预期可以提供针对具体问题的充分证据,如超说明书使用剂量的安全有效性数据、合并用药数据等;
4)经过外推模型确定的儿童剂量,在外推可靠性高、安全性风险小的情况,可作为批准或条件性批准的验证证据;
5)难以在某年龄段人群中独立开展随机对照临床试验(Randomized Controlled Trial,RCT)或某年龄段人群无法参与关键RCT,如早产儿、新生儿等。
目前国内已批准的案例包括:(1)真实世界证据支持上市后安全性证据收集;(2)真实世界证据支持外推剂量合理性。
其中,“真实世界证据支持外推剂量合理性”需同步参考《成人用药数据外推在儿科人群药物临床试验及相关信息使用的技术指导原则》),此案例仍然属于药品上市后通过豁免中国儿童临床研究的方式增加原研药已批准的儿童适应症。
由此可见,真实世界研究证据依然不能作为新药最开始上市注册的依据,只能作为上市后的数据补充方式。
优先审评,儿童药的倾向性?
主要剂型:颗粒剂、口服液、注射剂
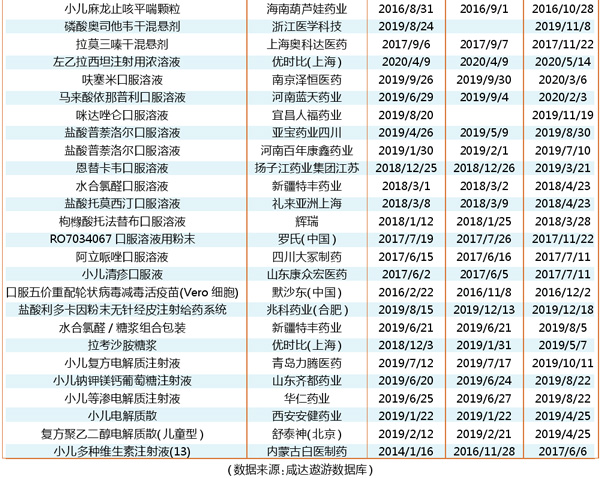
CDE的纳入优先审评品种名单中,三年以来,颗粒剂、口服液和注射剂依然是儿童用药优先审批常见的剂型。
颗粒剂中,除了成都倍特的头孢地尼颗粒、重庆华邦的对氨基水杨酸肠溶颗粒是“申请人主动撤回并改为按与原研药质量和疗效一致的标准完善后重新申报”的仿制药注册申请纳入优先审评程序,上海中医药大学的藿苓生肌颗粒暂无优先审评理由,其余都是以“儿童用药”为理由纳入优先审评程序。
北京韩美的右旋布洛芬混悬液虽是儿童用药,但是以“申请人主动撤回并改为按与原研药质量和疗效一致的标准完善后重新申报”的仿制药注册申请纳入优先审评程序。
带“儿”字的产品中,玛路弘和北京国仁堂的儿童用罗培南钠干糖浆暂无优先审批理由。
展望
儿童药成为行业热点,集中在研制国内未上市的儿童药。主要有以下四个方向:
1.改良新药:将目前已经有儿童适应症/用法用量的口服固体制剂改为口服用的溶液剂。这个方向主要涉及的难度是矫味问题。
2.仿制国外已上市国内未上市的儿童特殊剂型产品:主要问题是境外数据的人种差异问题。从注册流程而言,可能要先获批成人适应症再用外推剂量合理性获批儿童适应症。
3.增加国内未上市国外已上市的儿童特殊规格:需要考虑境外数据的人种差异问题。此外需要注意:特殊规格未必能在带量采购中获得价格优势以及允许挂网采购必定的中标资质,投资的回报价值不大。
4.儿童新药:预计会是国内已上市新药往儿童药方向发展。但是,由于国内没有像欧美那样,增加儿童的适应症和用法用量可以延长数据保护期或专利保护,国内新药企业开发儿童适应症动力稍不足。而且,近几年获批的新药以肿瘤为主,成人适应症的市场规模可观,儿童病例罕见,因而开发动力更加不足。
鉴于上述原因,第一种和第二种将是短期内儿童药物研发的热点。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






