新兴抗癌靶向药激情难挡
发布时间:2020-07-15 14:08:51作者:李勇来源:医药经济报
2019年近90个ADC进入临床试验
随着检测和诊断的进步,迫切需要创新的治疗方法提高肿瘤患者的生存率。尽管近年来在许多适应症上取得了不错的进展,但自上世纪70年代以来,食道癌和肺癌患者10年生存率提高不到10%,胰腺癌则根本没有改善。在黑色素瘤、乳腺癌和子宫癌等癌症中存活率虽有改善,但仍然需要更有效且副作用更少的治疗药物。
抗体-药物偶联物(ADC)是新兴的靶向治疗药物,具有改善传统化学疗法治疗指数的潜力。ADC由三部分组成:单克隆抗体或抗体片段(靶向肿瘤相关抗原)、具有高度细胞毒性的分子实体以及化学连接器。
发挥ADC的潜力取决于优化ADC每个部分。以下几种因素决定着ADC临床应用的成败,包括:抗体选择、异质性和靶点表达的水平,有效载荷效力和作用机制,偶联策略以及可裂解与不可裂解连接器的选择。为了确保足够宽的治疗窗范围,偶联应在血浆中稳定,以防毒素在全身循环中过早释放,并利用一旦释放到细胞内就具有足以消灭肿瘤的细胞毒性有效载荷。
7款ADC已获FDA批准
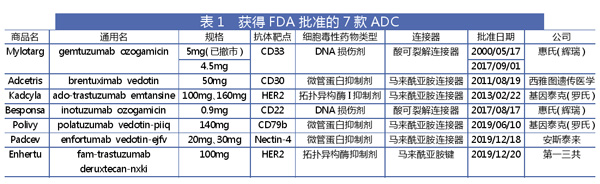
目前,已有7款ADC获得FDA批准用于治疗癌症:brentuximab vedotin(Adcetris),曲妥珠单抗emtansine(Kadcyla),inotuzumab ozogamicin(Besponsa),gemtuzumab ozogamicin(Mylotarg),polutuzumab vedotin(Polivy),enfortumab vedotin (Padcev)和曲妥珠单抗deruxtecan(Enhertu)。
Adcetris、Polivy和Padcev通过马来酰亚胺连接器与微管蛋白抑制剂单甲基auristatin E(MMAE)偶联,Kadcyla通过马来酰亚胺连接器与微管蛋白抑制剂Mertansine(DM1)偶联。Besponsa和Mylotarg通过酸可裂解连接器与DNA损伤剂加利车霉素偶联,而Enhertu通过马来酰亚胺键与拓扑异构酶I抑制剂deruxtecan偶联。
ADC技术的临床和商业潜力体现在迅速发展的研发线上,2019年有近90款ADC进入临床试验阶段。
达到有效载荷有难度
第一代ADC偶联了熟悉的化学治疗药物(例如甲氨蝶呤、长春碱和阿霉素),即使已经与抗体偶联以提高其特异性,也缺乏足够的疗效。cBR96-阿霉素偶联物在临床前研究中显示出了潜力,并已进入Ⅱ期临床试验,但疗效不足。这主要是由于阿霉素有效载荷的效力不足。
直到最近,大多数正在开发的ADC都使用来自以下三种类型的毒素:加利奇霉素(惠氏/辉瑞)、美登素(ImmunoGen)和澳瑞他汀(西雅图遗传学)。这表明找到合适的有效载荷以供ADC领域使用难度很高。
为了达到预期效果,毒素需要具有足够的效力以起到疗效。ADC设计中使用的细胞毒性分子理想地具有亚纳摩尔效价,以获得最佳疗效。由于肿瘤定位和内化不足,靶细胞中的有效负荷浓度通常较低。毒素还应具有用于偶联连接器的官能团,或应进行化学修饰生成合适的位点以允许在肿瘤细胞中释放。另外,细胞毒素的生产还应具有成本效益。
奥利斯他汀(auristatins)和美登素(maytansine)类的微管蛋白抑制剂已被广泛使用。这些偶联物已在多种适应症中获批,但它们在靶抗原或细胞表达较低和对微管蛋白抑制较不敏感的适应症中效果大打折扣。因此,研究者一直致力于设计有效载荷,以解决微管蛋白ADC活性不足的适应症,如结肠癌。
DNA损伤剂是ADC开发中使用的另外一种主要毒素。DNA损伤剂应用包括加利车霉素有效载荷包括inotuzumab ozogamicin和gemtuzumab ozogamicin以及duocarcin,拓扑异构酶抑制剂,吡咯并苯二氮卓(PBD)和indolinobenzodiazepines(IGN)。DNA损伤剂由于与DNA相互作用的有效载荷,在非增殖细胞中具有活性,因此可以扩大靶点的范围,使其包括肿瘤引发细胞(TIC)。
毒性和稳定性
最近有临床试验数据表明,含PBD的ADC在患者中引起严重的毒性问题。例如,靶向CD33的vadastuximab talirine在Ⅲ期临床试验中由于安全性问题而中止。临床试验的失败引起了从交联剂研究转向DNA单烷基化剂(如IGN),而IGN具有与PBD相似的效力。交联的IGN也有毒性,但DNA烷基化IGN并未显示出长期或延迟的毒性。
在第一代ADC中,偶联稳定性是削弱疗效的第二个因素,随着开发出更强大的有效载荷,这一因素变得更加关键。第一代ADC主要通过天然存在于抗体结构中的半胱氨酸和赖氨酸残基偶联有效载荷。但是,使用酸可裂解连接器的gemtuzumab ozogamicin与药物在循环中的非特异性释放有关。第二代ADC通常使用基于马来酰亚胺的偶联化学方法,并与含硫醇的蛋白质交叉偶联。
该领域的进步已使偶联技术具有更高的稳定性,例如开环的马来酰亚胺具有稳定的抗偶联能力。第三代ADC使用了位点特异性的偶联策略,例如工程半胱氨酸和非天然氨基酸工程。
[结语]
越来越多的临床前和临床数据指引着ADC的发展,因为这一治疗类别与当前的标准化学疗法相比,在疗效和耐受性方面越来越具有优势。更深入的研究结果也将有助于指导有效载荷和偶联策略的不断创新,这些创新可能会改善实体瘤的疗效,并扩大适应症的范围。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






