注射剂成一致性评价主力 药企立项仍需全面衡量
发布时间:2020-07-03 15:52:32作者:本报记者 张松来源:医药经济报
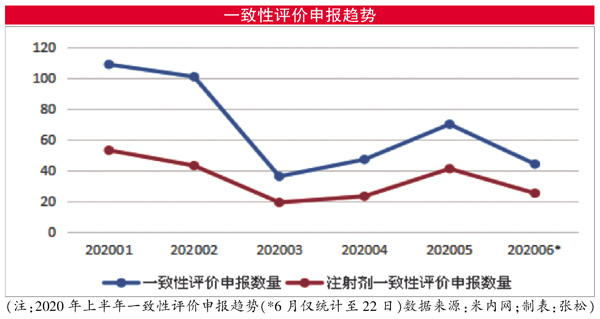
米内网MED中国药品审评数据库2.0显示,截至6月22日, CDE今年以来已累计承办一致性评价受理号407个,其中注射剂受理号为204个(涉及83个品种),占比超过半数。国家药监局此前发布《关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告(2020年第62号)》,标志着我国注射剂仿制药一致性评价正式拉开序幕。
注射剂评价占半壁江山
作为院内市场的主力品种,化药注射剂有着近6000亿元的市场规模。在国家药品带量采购常态化进展下,临床使用量较大的注射剂毋庸置疑将是未来重点纳入的品种。“通过一致性评价”作为参与带量采购的首要门槛,正在驱动以期获得集采政策红利的仿制药企业争先布局。
在顶层设计规划和政策引导下,仿制药企业对注射剂一致性评价的申报热情高涨。分析近半年的数据可以发现,注射剂一致性评价一直占据着CDE受理号的半壁江山,在受年初爆发的新冠肺炎疫情影响、受理数量锐减的3月和4月亦是如此。而随着国内疫情得到全面控制,CDE受理申报工作逐渐恢复如常,其在5月承办的一致性评价受理号达到70个,其中注射剂的申报数量为41个,占比提升接近至六成。
在业内看来,注射剂一致性评价工作的全力推进,在加速产业洗牌、提升我国仿制药质量水平的同时,也在进一步保障临床的用药安全。化药注射剂是现阶段临床上发生不良反应的重灾区,国家药品不良反应监测年度报告(2019年)显示,按剂型统计,2019年化学药品不良反应/事件报告中,注射剂所占比例为66.2%,远远高于口服制剂的29.8%。
原中国食品药品检定研究院化学药品检定首席专家胡昌勤在近期的线上论坛表示:“从保障药品质量角度来讲,安全、有效和质量可控是最为重要的三大要素。我们希望通过一致性评价解决的关键问题包括临床中已暴露出的不等效问题、降低临床不良反应发生率、国家评价性抽检中已揭示的突出质量问题以及产品质量的持续一致性问题。”
值得注意的是,相较于口服制剂,注射剂的评价研究要求显然更高,药企如何立项需仔细衡量。上海美迪西生物医药有限公司制剂部高级主任周晓堂认为:“国家层面对如何开展注射剂一致性评价已出台了相应的指导原则,这对药企的工作开展起到了重要作用。指导原则也明确,在开展研究时,首先要去关注所仿制的注射剂在国内外的上市情况,包括安全性、有效性方面的数据是否完整,以及在上市后是否监控到一些比较严重的不良反应等,最终整体评定项目是否具有市场和临床上的价值。”
特殊注射剂立项需全面衡量
在确定立项价值后,药企便可进入实操阶段。谈及仿制药一致性评价的策略与方法,胡昌勤认为可以归纳为以下几个步骤:“首先要分析国产制剂与参比制剂或者原研品的主要差异,判断关键质量属性是否一致。第二步要探讨出现这些差异的原因,否则不能从根本上改变质量状况。当明确原因后,要找到一个合理的解决方案,最后就是工艺改进与优化,以及产品控制的问题。”
而具体到化药注射剂,周晓堂表示,在实施过程中有多个方面需要药企加以注意。“摆在首位的是要注重参比制剂的研究,因为一致性评价一定是要有个参照物,在研究过程中要尽可能与其一致,以降低成本,满足国内市场需求。其次还要关注产品本身的处方、工艺、原辅料和包材,以及注射剂的质量研究是否充分到位、样品的稳定性好坏等情况。”
在处方方面,周晓堂认为,药企可能不只是要关注注射剂是水针,还是冻干粉针等制剂形式,也要考虑到产品有无附带溶剂。“因为有些产品的装置除了药液本身,还配备专有溶剂用于溶解,其安全性同样需要受到重视。”而在工艺方面,对于注射剂而言,无菌制剂是其较为重要的一项特征。“如何保证无菌,是通过灭菌还是无菌操作等方式,都是药企注意的要点。”
此外,周晓堂也提醒,包材等内容是药监部门近期要求较为严格的地方。“由于包材和药液直接接触,二者的相容性以及是否会产生其他杂质等都需要关注,包括在生产过程中接触到的生产线上的材质、在临床上使用时涉及到的输液袋和注射器等,目的是对药品的安全性和有效性能够起到进一步的保障作用。”
在5月份一致性评价新申报的品种中,盐酸多柔比星脂质体注射液等特殊注射剂赫然在列。对于剂型复杂、高技术壁垒的特殊注射剂如何取舍过评的问题,周晓堂给出了建议:一是从临床价值出发,对于某类适应症,要看市场上有无普通注射剂,是否已经满足患者需求,如果答案是肯定的,特殊剂型的高开发成本可能会导致最后的市场收益并不乐观,药企要从利润等维度去考量该产品在临床上的准确价值。二是企业定位,要看品种是否与药企专注的适应症、研发管线匹配,因为只有在熟悉或者具有更多优势的领域,产品推广才会更加容易。三是项目成本,由于不是独家产品,同其他厂家竞争会产生成本问题,在开发立项要考虑其成本是否在合理范围内,而成本和核心原料、辅料,以及生产方式、批量密切相关,须多维度考量。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






