10个新冠疫苗进临床 还有100多个临床前“后备军”
发布时间:2020-06-29 16:08:57作者:廖联明来源:医药经济报
10个新冠疫苗进临床
还有100多个临床前“后备军”
世界各国疫苗研究人员都在加速推进COVID-19(新冠)疫苗研发,目前已有10种候选疫苗进入临床试验。但挑战依然存在。
疫苗的研制通常是一个漫长的过程。一般而言,研制疫苗至少需要10年时间。在埃博拉病毒被发现43年之后,第一个埃博拉病毒疫苗才于去年被美国FDA批准。艾滋病毒或呼吸道合胞病毒疫苗方面,则是投入了大量资金,但进展甚微。而随着新冠危机的日益加重,每个人都希望这个疫苗会有所不同、会更快。
可能会有不同。目前,已有10种COVID-19疫苗正在进行临床试验,牛津大学和阿斯利康公司的研究人员希望今年夏天获得第一个Ⅲ期临床研究数据。许多传染病专家认为,即使花了18个月时间才研制出第一个接种疫苗,也是极其快速的计划。但是,一些乐观主义者相信,到2020年底,可能已经能够推出数亿支疫苗。
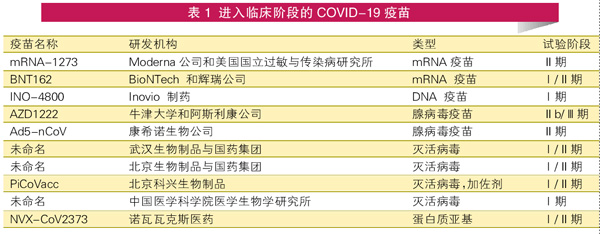
进入临床项目
以新技术为主,速度快,但疗效、产能难料
比尔盖茨医学研究所(Bill&Melinda Gates Medical Research Institute)的疫苗学家兼首席执行官佩妮·希顿(Penny Heaton)说:“到目前为止发生的一切令人惊叹。”她说道,此前对新疫苗技术平台的大量投资使“快疫苗”成为可能。
事实上,研发速度最快的候选疫苗正是利用了新兴的技术平台。Moderna公司的mRNA-1273在SARS-CoV-2首次测序66天后进入临床试验,展示了基于核苷酸的疫苗的潜力。Moderna公司的疫苗不是使用减毒的SARS-CoV-2来传递编码,而是使用合成的脂质纳米颗粒携带mRNA模板。
牛津大学和阿斯利康公司采用了一种名为AZD1222的重组疫苗。该疫苗是改造的黑猩猩腺病毒,携带有刺突抗原的DNA。由于腺病毒本身具有免疫原性,这种方法可以产生强大的记忆B细胞并引起T细胞反应,从而在较少的剂量下产生更好的预防效果。
但无论是基于核苷酸的疫苗还是基于腺病毒的疫苗,在 COVID-19爆发之前都没有一个在美国或欧盟获得批准上市。mRNA编码的抗原是否可以针对病原体起到足够的保护作用还有待观察。早期的腺病毒疫苗的试验令人失望,部分原因是一些受试者在注射腺病毒载体疫苗之前就已经有相应的免疫力。此外,这两种疫苗以前都没有被大规模生产过。
临床前项目
进度慢、成功率低,或是纸上谈兵
其他公司则专注于更成熟的技术。赛诺菲公司(Sanofi)和葛兰素史克公司(GlaxoSmithKline)是四大疫苗生产商中的两家,正在共同研究蛋白质亚单位的方法。他们的主要候选疫苗包括刺突抗原本身,与免疫原性佐剂结合,以触发强烈的免疫反应。两家公司希望在今年年末开始Ⅰ期临床试验。
据世卫组织统计,全球一共有100多个处于临床前研发阶段的候选疫苗。人类疫苗项目的首席执行官韦恩·科夫(Wayne Koff)警告说,许多临床前期项目都是纸上谈兵。不过,他补充说,考虑到每种疫苗的相对利弊,有多种候选疫苗还是好的。
虽然疫苗学家希望多种疫苗最终都能够成功,以部分缓解生产压力,但成功的可能性却很小。牛津大学的疫苗学家、开发AZD1222的团队成员阿德里安·希尔(Adrian Hill)说,疫苗研制成功的概率一般为6%。
尽管需要速度,但仍需要谨慎。一系列小型且快速推进的临床试验让医学界对这些疫苗的安全性和有效性产生了许多疑问。疫苗的一个关键风险是,无效的疫苗可能通过增强抗体反应或其他机制使病人的疾病恶化。
研发难点
如何快速生成高质量数据?
当研发团队正在努力解决如何快速高效生成高质量数据的问题时,有几个问题显得尤为重要。流行病预防创新联盟(CEPI)疫苗开发主管梅兰妮·萨维尔(Melanie Saville)说:“我们需要了解的最重要的事情之一是发病率。发病率越高,在一定时间内感染该病的人群比例越高,试验就可以更快地得到结果。”
其他因素也要考虑。一些疫苗学家认为,任何最终接种的疫苗都应优先考虑易受感染的个体和一线医护人员。但是,包括老年人在内的易感染个体,如果遵守安全距离的建议,应该有较低的感染率,从而增加收集这些患者疗效数据所需的样本量和时间。因为老年人的免疫系统比年轻人的免疫系统差,所以老年人群体的结果可能无法等同于年轻人群体的结果。
牛津大学和阿斯利康公司是第一个开始进行Ⅲ期临床试验研究的机构,主要关注18~65周岁的健康成年人,研究人员既在一线医疗机构工作,也是普通大众。10000名受试者的临床试验已经在英国进行。该试验还招募了少量老年人和儿童,以开始评估这类群体的疗效。今年夏天,美国的30000名志愿者将对重组疫苗进行更大规模的试验。
美国国立卫生研究院、世卫组织和其他机构的研究人员也在考虑其他选择。如病毒刺激试验,志愿者接种疫苗,然后用活病毒刺激,可以加快试验速度。但这种方法的伦理和科学价值仍有待商榷。
还可以在一个试验方案下测试多种疫苗。通过对入组标准和试验终点等方面的标准化,可使比较和对比研究结果变得更加容易。还有一些实际的好处,比如可以使用单个安慰剂组来减少这些试验的总体规模和成本。
疫苗开发人员还需要通过免疫相关性指标进行不同疫苗的比较。在一个疫苗宣称取得成功时,将需要进行独立的验证,以确保只有最佳的候选疫苗继续向前推进。希尔说:“我坚决认为,应该在一个集中的实验室里进行免疫相关性的测试,我真正想要的是对不同试验中的免疫反应进行直接的比较。至少,免疫相关性的分析需要标准化。”
此外,如果某个疫苗研制成功,巨大的全球需求量意味着产能的巨大压力。现在有的研发公司已经开始准备扩大生产规模,尽管他们所看好的候选疫苗可能最终被证明无效。随着公共部门在候选疫苗的研发上投入大量资金,越来越多人呼吁普及疫苗,但民族主义、地理和商业因素可能会阻碍疫苗的普及。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






