欧盟PRIME计划 激发药企创制热情
发布时间:2020-06-28 16:49:52作者:张方 李佳逊来源:医药经济报
欧盟PRIME计划激发药企创制热情
PRIME资格申请要求药物需具有为患者提供临床相关优势的潜力,在很大程度上填补了未满足的医疗需求空白
我国近年来推进并逐步完善优先审评审批制度,已初见成效。相较于我国短时间内的快速发展,欧洲药品管理局(EMA)也不断更新相关政策和细化配套措施,加速新药审评审批程序,缩短药品审评周期,鼓励企业创新,结合市场发展和临床需求,为存在临床价值的药物研发和审批提供帮助。
本文通过分析2012年3月至2020年5月EMA新药审批情况,分析其加速审批政策的实行情况和新药审批趋势。
加速新政PRIME
研究表明,FDA的同种新药审批速度比EMA快,这也为EMA提供了更多关于新药的有效性和安全性信息,EMA可能会给予新药比FDA更多的适应症。
EMA关于药品审批的政策在不断更新。
早在1995年,EMA实行特殊情况政策(Exceptional circumstances),特别关注药物安全性;2006年,实行有条件批准政策,关注针对严重疾病、罕见病及突发卫生事件的药品和疫苗;2016年,EMA推行PRIME快速审评程序,通过快速、科学的建议、滚动审查、加快评估等程序,加速药品审批,加快药物和疫苗的开发支持和批准。
PRIME资格申请要求药物需具有为患者提供临床相关优势的潜力,可以在很大程度上填补未满足的医疗需求空白。申请人需提供相关非临床和临床数据证明药品安全性、有效性和质量可控性,根据治疗效果的持续时间以及所观察到的临床治疗结果的相关性,判断该药是否适用于PRIME。
此外,相关要求还明确了申请资料的完整性和可靠性, 在药品投放市场获得充分数据表征其安全性后,结合多方面临床信息和疗效大小做出合理结论。但是,如果现有治疗已经严重影响了患者生活质量,EMA也会考虑特殊情况提前给予支持。
近年审批情况
整理2012年3月到2020年5月数据可知,EMA共发布新药申请信息597条,涉及治疗领域67类;其中孤儿药申请199条(33.3%),涉及治疗领域41类。
1.审评审批加速
2012年,共提交包括36个孤儿药在内的125个新药申请,导致新药审批积压,这不光给审评机构带来压力,也致使企业经历漫长的等待。为加快药品审评,致力于临床急需,PRIME以明确清晰的申请条件和多方位助力企业。
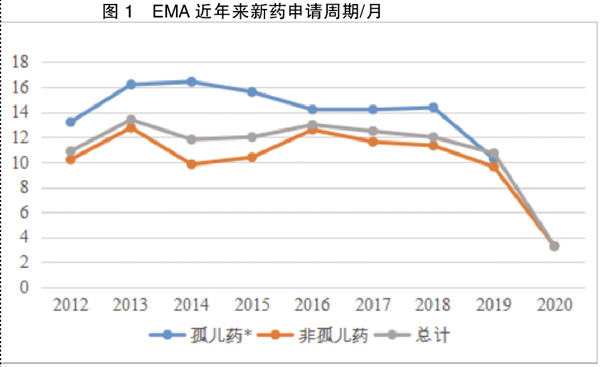
针对有价值的新药开发,从临床前研究开始就提供科学建议以获得可靠数据,授权后通过滚动式审评和加快评估,缩短新药审批周期。从2016年开始,即使新药申请数量增幅减缓,新药审批速度也在逐渐加快。对比2019年和2020年申请数量和审批成功数量的明显转变,2019年下半年,大部分申请周期为6~7个月;2020年上半年,申请周期集中于5个月以内。新政策的实施减缓了审评机构和企业的压力,造福民众健康生活。
2.申请周期渐进式缩短
加速审批并不意味着盲目提速。不同于仿制药,新药审批更应注重药品审批的两面性,既要加快审批以满足临床急需,也要确保足够的审批时间,以保证临床试验结果证明药品安全有效且质量可控。
整理数据中,申请数量较多的几类研究领域的药物审批周期接近均值,而同领域的孤儿药审批周期略高于非孤儿药,表明对于缺乏参考数据的罕见病治疗药物,EMA会花更多时间评估,以保证药物安全性和有效性。
3.鼓励孤儿药开发
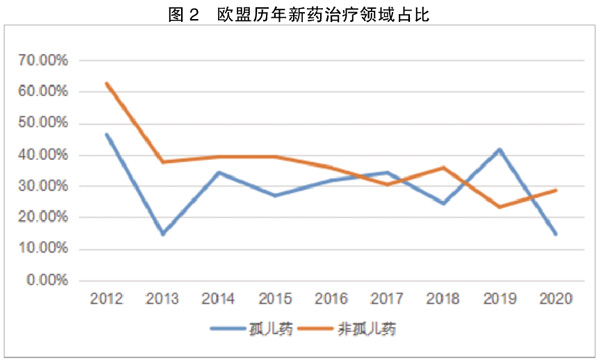
虽然EMA的新药批准速度和质量还难以与FDA相比,但仍有部分新药或新技术早于FDA批准,且加速新药审评的政策不断推陈出新。而无论是新药申请数量还是审批成功数量,孤儿药在其中的占比都呈逐年上升态势。
特别是在罕见病治疗、重大卫生事件疫苗开发,尤其受到当今社会重视,EMA更偏向于孤儿药加速审批。对于席卷全球的新冠疫情,EMA也及时发布政策鼓励疫苗研发,积极给予科学建议和支持。当然,EMA对于不同种类的新药申请一视同仁,对于临床试验结果存在争议的申请也会果断拒绝。数据显示,目前为止已拒绝11个孤儿药申请。
4.品类多样化,治疗领域集中
在统计的597个新药申请中,孤儿药涉及41个治疗领域,非孤儿药涉及56个治疗领域,药品种类呈现多样化,而孤儿药申请所涉及的治疗领域正逐渐增加。
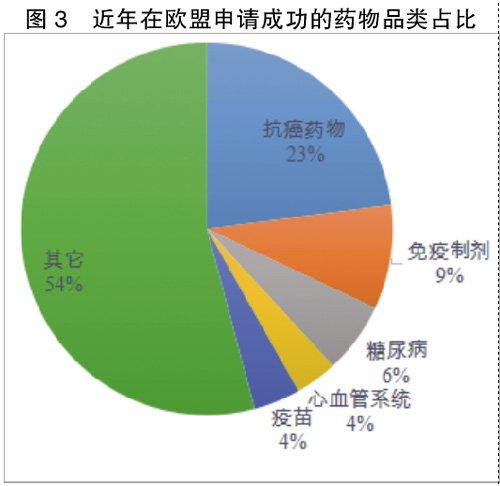
WHO发布的《2019年世界卫生统计报告》指出,2019全球十大健康威胁位居第二的是非传染性疾病(主要包括心脑血管疾病、癌症、糖尿病、慢性呼吸系统疾病)。抗癌药物、免疫制剂、糖尿病、心血管系统、疫苗等重点药物的申请数量和审批数量,在总量中都占据较大比重,这几类治疗领域的孤儿药研发和新药申请也不断增加。
新药的治疗领域主要集中在重大疾病、罕见病和疫苗领域,对于全球共同面对的健康难题,新药研发企业和审评机构都在努力攻克难关,争取早日填补空白。
未来审批趋势
1.投资回报周期变短
欧盟改进药品审评政策并实行PRIME快速审评程序,配合详细的实施细则和不同阶段的执行时间表,保证政策落实。
就在实行PRIME快速审评程序的2016年前后,欧盟的新药获批数量和孤儿药申请数量都有明显增加,且不同种类新药的申请获批周期在2016年后都呈明显下降,加速政策给企业带来了更多的机遇和创新的可能——必要的提交前对话,让审评机构提早掌握研究数据,提供科学建议以加快新药审评进度,提高审批质量。加速阶段的实施细则和执行时间表,使得企业能够针对自身情况制定不同计划,缩短投资回报周期,节约资源。
2.重点领域创新突破
由于抗癌、糖尿病、免疫等治疗领域的新药申请数量和审批数量占比较大,其仍然是欧盟重点关注的治疗领域,不光因为这几类疾病是全人类健康的主要威胁,也表明这几类治疗领域的临床需求仍未被满足,存在可突破创新之处。
此外,重点治疗领域的孤儿药开发创新不断,为鼓励孤儿药开发,EMA的做法还加大了审评中孤儿药的数量占比,近年来孤儿药新药所涉及的治疗领域不断拓宽。
(本文作者张方系沈阳药科大学副教授)
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






